4.原子の基本的性質
原子核の外側には電子が取り巻き,電子は一定の軌道上を回転しているというボーアのモデルは基礎化学で学んだ。
ここでは簡単に結果をまとめる。
(1)電子軌道
電子の状態は4種の量子数で表現される(表1-3)。

原子の電子状態を示すには主量子数を数字で,方位量子数を記号(s,p,d,f)で示す。
方位量子数0,1,2に対応するs,p,d各軌道の広がる方向を図1-1に示した。
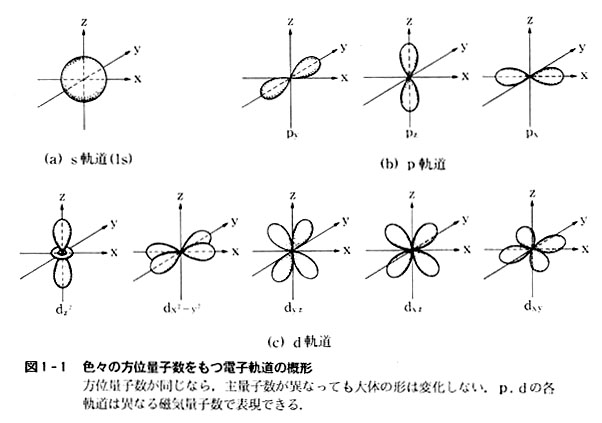
どのような場合でも,電子は4種の量子数がすべて等しい状態をとることはできない。(パウリの原理)
各元素の電子は電子軌道のうち,最もエネルギーの低い軌道から順に占めて行く。
軌道エネルギーは主量子数の小さいほど,同一主量子数の時は,方位量子数の小さいほど低い。
しかし,幾らかの入れ替わりもあり,だいたい次の順になっている。
1s 2s 2p 3s 3p 4s〜3d 4p 5s〜4d 5p 6s〜5d〜4f 6p 7s〜5f〜6d (1.1)
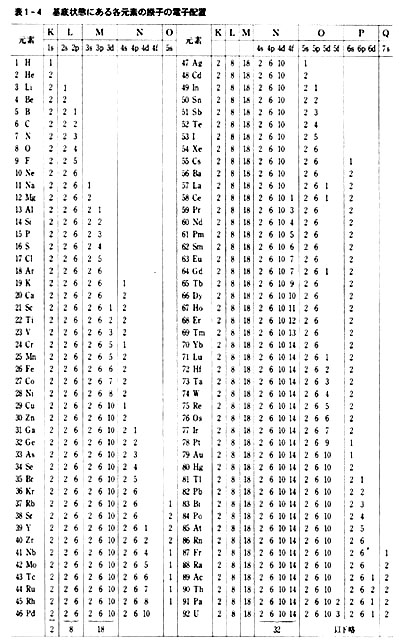
各元素の原子が単独で最も安定な(エネルギーの低い)状態(基底状態)にある時,どのような電子配置をとるかを表1-4に示した。
この表は種々の原子の性質を考える時の基礎となる。
磁気量子数とスピン量子数は基底状態ではエネルギーに差を与えないが,原子が他の原子と結合する時は重要な意昧をもち,また物質の磁性を支配する因子ともなる。
表1-4は基底状態の時の電子配置であり,原子がエネルギーを受け取って励起状態になったり,イオンになった時は軌道エネルギーの順序は変化し,電子配置も変化する。
(2)イオン化エネルギー
原子の性質として最も重要なのは,電子がどのくらい強く原子に束縛されているかという程度である。
これはある原子から電子1個を引き離して1価陽イオンに変えるのに必要なエネルギー―イオン化エネルギー(1次[第1]イオン化エネルギー)―で表示する。
図1-2には各原子の最外側電子配置とともに,1次イオン化エネルギーの値を示した。
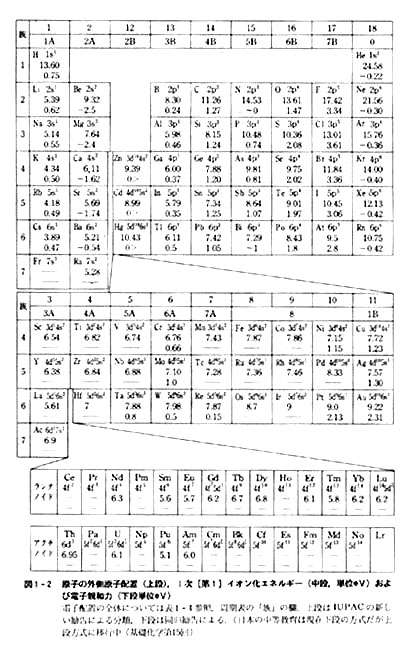
1価陽イオンからもう1個の電子を引き離して2価陽イオンにする時必要なエネルギーを2次[第2]イオン化エネルギー,以下3次[第3],4次[第4]の値も測定されており,金属原子から多価陽イオンのつくりやすさを考える時に重要である。
基底状態における原子の電子配置と1次イオン化エネルギーには密接な関係があり,それは式(1.1)の順列とも関連する。
この点は基礎化学の科目で詳しく扱われたのでここでは省略する。
(3)電子親和力
原子に電子1個を付け足して1価陰イオンにする時にはエネルギーが放出される場合と吸収される場合がある。
前者を正,後者を負の数値で示す。エネルギーを吸収するのは希ガス元素と,2A,2B族元素に限られる。
エネルギー放出の場合でも最大3.5eV(ハロゲン元素)に留まり,イオン化エネルギーにおけるほど大きい差はない。
2価陰イオンをつくる時はすべてエネルギーを吸収する。
(4)電気陰性度
イオン化エネルギーは原子が電子をどの位強く捕まえているかの尺度であり,電子親和力は外から電子をどの位取り込みやすいかの目安であるから,両者を平均すれば原子と電子との間の親和性の尺度となるであろう。
こうして求めた値をマリケンの電気陰性度という。
電気陰性度は原子の性質を比較するための相対値であるから,絶対値には意味がない。
しかし原子の基本的性質を考える上できわめて重要な意昧を持ち,いろいろの方法で算出する試みがされている。
(マリケンの値も他のデータと比較しやすいよう換算する。)
図1-3にはいろいろの方法で求めた電気陰性度(x)の平均的な値を示した。





