係.HSAB尨棟
乮侾乯嬥懏僀僆儞偺宯摑揑掕惈暘愅丂
丂悈梟塼拞偵娷傑傟傞庬乆偺嬥懏僀僆儞傪専弌偡傞曽朄偼屆偔偐傜尋媶偝傟偰偒偨偑丆傕偭偲傕曋棙偱峀偔梡偄傜傟偰偄傞曽朄偼棸壔悈慺傪庡梫側帋栻偲偡傞丏
偡側傢偪昞10-2偺傛偆偵丆壗偑娷傑傟偰偄傞偐晄柧偺悈梟塼偵昞帵偺帋栻傪弴師壛偊偰惗偠偨捑揵傪鄅偟暘偗丆僀僆儞傪僌儖乕僽暘偗偟偰偐傜丆奺僌儖乕僾偛偲偵屄乆偺僀僆儞傪専弌偡傞

乮棸壔悈慺偼廘偔偰丆懡検偵媧偆偲桳撆偲側傞嫲傟傕側偔偼側偄偐傜幚尡偵偼拲堄偑偄傞乯丏
丂偙偺僌儖乕僾暘偗傪傒傞偲丆戞侾丆俀丆係懏偼棸壔暔偑捑揵偟丆嬥懏僀僆儞廃傝偵巁慺尨巕傪傕偮悈榓僀僆儞傛傝棸壔暔僀僆儞偑嬤偔偵偁傞曽偑埨掕偱偁傞丏
戞俁丆俆丆俇懏偼嬥懏僀僆儞廃傝偵巁慺尨巕偑懚嵼偡傞悈巁壔暔丆扽巁墫傑偨偼悈榓僀僆儞偦偺傕偺偺曽偑埨掕偱偁傞丏
偮傑傝慜幰偼恊棸墿惈僌儖乕僾丆屻幰偼恊巁慺惈僌儖乕僾偲偄偆偙偲偑偱偒傞丏
乮俀乯倎惈偲倐惈
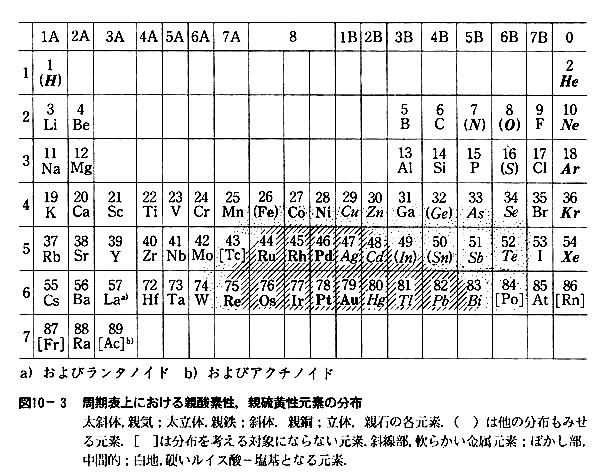
丂嬥懏僀僆儞偑偳偺傛偆側暘巕傗僀僆儞偲攝埵寢崌傪嶌傝傗偡偄偐偼嬥懏嶖懱偺埨掕搙偲偟偰掕検揑偵昞帵偱偒傞.乮戞11夞乯
嬥懏僀僆儞偺廃埻偵懠偺暘巕傗僀僆儞乮偙傟傜傪攝埵巕偲偄偆乯偑暲傫偩忬懺偑嶖媥偱偁傞丏
懡偔偺嬥懏僀僆儞偵偮偄偰應掕偝傟偨嶖懱偺埨掕搙僨乕梉傪廤寁偡傞帪丆攝埵巕偺暘巕峔憿偼柍帇偟偰丆捈愙嬥懏僀僆儞偲寢崌偡傞尨巕乮攝埵尨巕乯偺庬椶偵拝栚偡傞偲丆嬥懏僀僆儞偑偳偺傛偆側攝埵尨巕偲寢崌偟傗偡偄偐偵傛偭偰師偺俀僌儖乕僾偵暘椶偱偒傞丏
a乯 F亜Cl亜Br亜I丂丂丂b乯 F亙Cl亙Br亙俬
丂丂O亜S亜Se亜Te丂丂丂丂丂O亙S亜Se亜Te
丂丂N亜P亜As亜Sb丂丂丂丂丂N亙P亜As亜Sb
丂棸墿傪攝埵尨巕偲偡傞棸壔暔僀僆儞丆僠僆傾儖僐乕儖椶丆僠僆僄乕僥儖椶偲傛傝丆巁慺傪攝埵尨巕偲偡傞悈丆僆僉僜巁僀僆儞丆僇儖儃儞巁僀僆儞丆傾儖僐乕儖椶偲丆嫮偔寢崌偡傞嬥懏僀僆儞偼倎孮偵暘椶偝傟傞丏
偦傟傜偼儕儞傪攝埵尨巕偲偡傞桳婡儂僗僼傿儞椶偲傛傝丆拏慺傪攝埵尨巕偲偡傞傾儞儌僯傾丆桳婡傾儈儞椶丆傾僕壔暔僀僆儞N3亅側偳偲寢崌偟傗偡偄丏
偦傟傜偼傑偨丆僴儘僎儞壔暔僀僆儞傪憡庤偲偡傞帪偼丆廃婜昞偺忋曽偺尦慺偺僀僆儞偲寢崌偟傗偡偄丏
倎孮偺僀僆儞偼偍傕偵廃婜昞偺嵍偺曽偵埵抲偡傞尦慺偐傜惗傑傟傞丏乮恾10-3乯
丂偙傟偵懳偟倐孮僀僆儞偼丆棸壔暔僀僆儞丆僠僆傾儖僐乕儖側偳偲寢崌偟傗偡偔丆桳婡儂僗僼傿儞偲偼傾儈儞椶傪憡庤偲偡傞傛傝嫮偄寢崌傪梌偊傞丏
傑偨儓僂壔暔僀僆儞丆廘壔暔僀僆儞丆墫壔暔僀僆儞丆僼僢壔暔僀僆儞偺弴偵寢崌偑庛傑傞丏
廃婜昞忋偱偼塃婑傝偺嬥懏尦慺偑倐孮僀僆儞偲側傝傗偡偄丏
倎,倐孮偺拞栤揑惈奿偺僀僆儞偼椉椞堟偺嫬奅晅嬤偵偁傞丏乮僯僢働儖丆垷墧丆摵側偳乯
乮俁乯帺慠奅偵偍偗傞尦慺偺懚嵼忬懺
丂偙偺栤戣偼乽婎慴壔妛乿偺戞14夞偱庢傝忋偘傜傟偨丏
僀儞愇側偳偺抧媴奜暔幙傪娷傔偰峫偊偰傕丆尦慺偺懚嵼宍懺偼昞10-3偺係庬偵惍棟偱偒傞丏
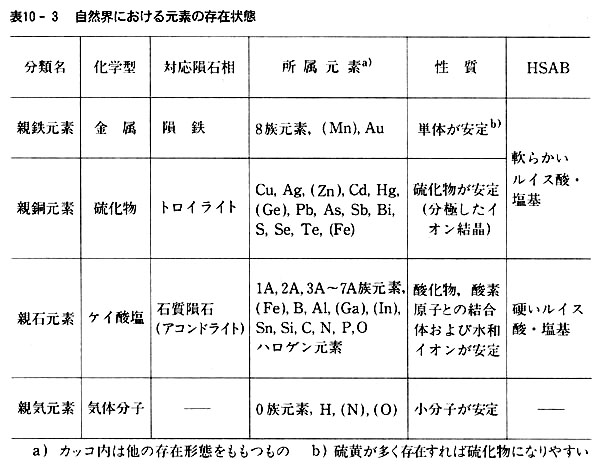
恊婥尦慺偺偆偪婓僈僗尦慺偼壔妛寢崌傪嶌傜側偄偐傜暿埖偄偵偡傞丏
恊揝尦慺偼嬥懏扨懱偲偟偰嶻弌偡傞偑丆偙傟偼帺慠奅偵棸墿偑彮側偐偭偨偨傔偲峫偊傜傟傞丏
乮偁傞尦慺偺慡検偑懡偄偐彮側偄偐偼丆尨巕妀偺惈幙偵傛傝寛掕偝傟傞偺偱丆尨巕偺壔妛寢崌偮傑傝揹巕忬懺偲偼柍娭學偱偁傞.乯
傕偟棸墿検偑傕偭偲偁傟偽丆恊摵尦慺偲偟偰嶻弌偟偨傕偺偲悇掕偝傟傞丏
偦偆偡傞偲帺慠奅偱偼巁慺偲寢崌偟傗偡偄尦慺偍傛傃棸墿偲寢崌偟傗偡偄尦慺偲偵擇戝暿偱偒傞偙偲偵側傞丏
僴儘僎儞尦慺側偳悈榓僀僆儞偲偟偰埨掕側傕偺偼丆恊巁慺偺拠娫偵擖傟偰傛偄丏
働僀慺丆儕儞側偳埨掕側僆僉僜巁僀僆儞傪嶌傞尦慺傕摨條偱偁傞丏
乮係乯巁丒墫婎偺峝偝丒擃傜偐偝
丂偙傟傑偱挷傋偨偙偲傪惍棟偡傞偲丆嬥懏尦慺偺婎杮揑惈幙偲偟偰偺恊巁慺惈丒恊棸墿惈偲丆嶖懱偺埨掕搙偵婎偯偄偨倎惈丒倐惈偲偼嬌傔偰傛偔懳墳偟偰偄傞偙偲偑敾柧偡傞丏
帺慠奅偺崅壏崅埑偺忦審壓偱尰傟傞惈幙偲丆幚尡幒偱偺壏榓側忬懺偱偺寢壥偑傛偔懳墳偡傞偲偄偆帠幚偼丆忋婰偺擇暘椶偑尦慺偺婎杮揑惈幙偵怺偔娭楢偟偰偄傞偙偲傪帵偡丏
攝埵寢崌偼杮幙揑偵儖僀僗偺巁丒墫婎偺娭學偲偟偰棟夝偝傟傞丏乮倫.69丆173乯崱倎孮偺梲僀僆儞傪峝偄巁丆偦傟偲寢崌偟傗偡偄暘巕傗堿僀僆儞傪峝偄墫婎偲屇傃丆倐孮偺梲僀僆儞傪擃傜偐偄巁丆偦傟偲寢崌偟傗偡偄暘巕丒堿僀僆儞傪擃傜偐偄墫婎偲柤晅偗傞偙偲偵偡傞丏
偦偺寢壥丆倫.158偐傜弎傋偰偒偨偙偲偼昞10-3偺傛偆偵傑偲傔傜傟傞丏
乮俆乯昗弨揹嬌揹埵偲偺娭學
丂俫俽俙俛尨棟偲昗弨揹嬌揹埵偲偼堦尒柍娭學偵尒偊傞偑丆尨巕偺惈幙偲偟偰峫偊傞偲椉幰偼偐側傝枾愙側娭學偵偁傞偙偲偑暘偐傞丏
昗弨揹嬌揹埵偼僀僆儞壔僄僱儖僊乕偍傛傃悈榓僄僱儖僊乕偵埶懚偡傞偑丆幃乮10.3乯丆偮傑傝偼僀僆儞偲揹巕偲偺恊榓椡偺戝偒偝偵巟攝偝傟傞丏
椺偊偽摵偺Eo偼惓偱偁傝丆悈榓偟偨摵乮嘦乯僀僆儞傛傝揹巕偲寢崌偟偨嬥懏摵偺曽偑埨掕側偙偲傪帵偟偰偄傞丏乮儮俧亙侽丆幃乮10.13乯乯
傾儖僇儕嬥懏丆傾儖僇儕搚嬥懏丆垷墧側偳僀僆儞壔孹岦偺戝偒偄嬥懏偺Eo偼晧偱丆僀僆儞偑揹巕傪懆偊偨忬懺偼悈榓僀僆儞傛傝晄埨掕偱偁傞丏
乮揹巕偲偺恊榓惈彫乯堦曽棸壔暔僀僆儞S2亅蛶_壔暔僀僆儞O2亅傛傝暘嬌棪偑戝偒偔丆嬥懏僀僆儞偺棸壔暔寢徎偼巁壔暔寢徎傛傝傕暘嬌偑挊偟偄丏
偙傟偼嬥懏僀僆儞偑憡庤堿僀僆儞偺揹巕傪堷偒晅偗傞掱搙偑戝偒偄偙偲傪堄枂偡傞乮幃7.3乯丏
偦傟備偊丆埨掕側棸壔暔傪梌偊傞嬥懏僀僆儞偼揹巕偲偺恊榓惈偑戝偱偁傞丏
昞10-2偺戞侾丆俀丆係懏偺奺僀僆儞偼昞10-1偺昗弨揹嬌揹埵偑惓偐丆愨懳抣偺彫偝偄晧偺抣傪帩偪丆揹巕偲偺恊榓惈偑戝偒偄偙偲傪帵偡丏
偦偺偨傔奣棯師偺娭學偑惉棫偡傞丏
丂擃傜偐偄嬥懏僀僆儞仺昗弨揹嬌揹埵偺戝偒偄僀僆儞
丂峝偄嬥懏僀僆儞丂丂仺昗弨揹嬌揹埵偺彫偝偄僀僆儞
丂恖椶偼怓乆偺嬥懏傪梡偄偰暥柧傪抸偄偰偒偨偑丆嬥懏偺梡偄傜傟巒傔偨擭戙偲昗弨揹嬌揹埵偲傪僾儘僢僩偡傞偲丆Eo偺戝偒偄嬥懏傎偳屆戙偐傜棙梡偝傟偰偄偨偙偲偑暘偐傞.乮恾10-4乯
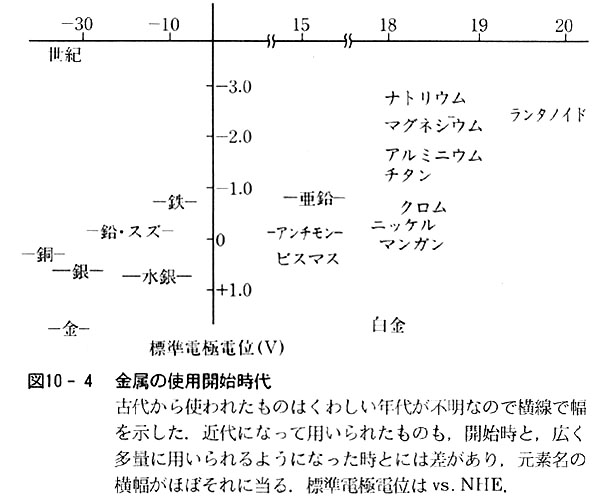
Eo偺戝偒偄嬥懏偼惢楙偑梕堈偱偁傞偩偗偱側偔丆帺慠奅偵棸壔暔偲偟偰懚嵼偟丆怓偑崟偭傐偔廳偔偰栚偩偪傗偡偐偭偨偨傔傕偁偭偰憗偄帪婜偐傜恖椶偵梡偄傜傟偨偲棟夝偡傞偙偲偑偱偒偦偆偱偁傞丏
帒椏採嫙丂廧桭嬥懏峼嶳夛幮



