3.錯体の性質と配位結合
錯体における中心金属イオンと配位子の間の結合を配位結合というが,この本質を直接実験で明らかにすることはできない.
構造-原子の配列--に基づいて,性質を合理的に説明できるような近似を行う.
この際に重要な性質として,吸収スペクトルと磁化率がある.
(1)色と吸収スペクトルのもつ意昧
可視・紫外部の光吸収は電子の遷移によって起こる.
光エネルギ-を吸収することによって低いエネルギー状態にある電子が高いエネルギーに移る.
それ故どのような波長の光が吸収されやすいかを知れば,物質中の電子のエネルギー状態を知ることができる.
また2種の物質の吸収スペクトルが一致すれば両者は同一物質と判定できる.
例えば塩化コバルト(Ⅱ)無水塩の水溶液と塩化コバルト(Ⅱ)六水和物の吸収曲線が一致するので,コバル卜(Ⅱ)イオンは水溶液中で結晶中におけると同様6個の水分子で正八面体形に囲まれていることが判明する.
遷移元素の特色の一つに色をもつ化合物が多いことが指摘される.
着色は光源(例えば太陽光)からの可視光線が一部吸収されて目に達することで起こり,図11-1のような吸収曲線(吸収スペクトル)で正確に表現される.
この横軸には波長を,縦軸には吸収される度合(吸光度)を目盛ってある.
モル吸光度εは溶質に特有な定数で,測定した吸光度Aとは式(11.13)で関係づけられる.
dは液層の厚さ,cは溶質のモル濃度I0 ,Iは入射光及び透過光の強度である.
log(I0/I)=A=εcd (11.13)
理論的な考察には横軸に波長の代わりに振動数(単位s-1)または波数(単位cm-1)を用いる.
光(一般に電磁波)のエネルギーは振動数にプランク定数hを乗じた積で表され,波長に光速度を乗ずれば振動数が求められるので便利である.
(2)磁性
物体を不均一な磁場に置くと,物体を構成している物質の性質によって磁場の強い方向に引っ張られたり,磁場の弱い方向に反発されたりする.
前者を常磁性物質,後者を反磁性物質と呼ぶ.
磁場の影響を受ける程度は磁化率で表示されるが,通常は真空の透磁率
4π×10-7Hm-1(Hはインダクタンスの単位へンリー)との比で示される.
磁化率は物質の電子状態によって決定される.
反磁性物質中では電子はすべて電子対を作っていて不対電子は存在しない。
これに対し常磁性はその物質中に不対電子が存在する証拠となる.
これらは分子レベルの性質(第1回)である.
常磁性磁化率の温度や,磁場強度による変化に基づき,さらに強磁性(フェロ磁性)・反強磁性・フェリ磁性等に分類されるが,それは分子集団レベルの性質で,第14回で詳しく扱う.
非金属元素および典型金属元素の化合物は,大部分が反磁性で,常磁性を示すのは結合電子総数が奇数の場合である.(NO,NO2,有機の遊離基等)
電子総数が偶数なのに常磁性を示すのは酸素分子が唯一ともいえる例外である.(最新の常磁性有機化合物は第15回参照)
しかし遷移元素錯体では,電子総数が偶数なのに常磁性を示す物が多い.
その原因を考察しよう.
錯体はディスクリー卜な物質(第1回)であるから,分子レベルで考察する.
常磁性錯体の場合,不対電子数 は磁気モーメンン卜μ と式(11.14)で関係づけられる.
ただしμはボーアマグネトン (9.274×10-24JT-1.Tはテスラーという磁束密度の単位でVm-2sに当る)を単位として表示する.
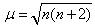 (11.14)
(11.14)
温度Tで測定したモル磁化率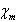 とμは
とμは
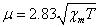 (11.15)
(11.15)
の関係にある.(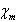 はmol-1単位)
はmol-1単位)
式(11.14)は簡易化した式で,磁気モーメン卜に寄与するのは電子のスピンだけだと仮定し,電子軌道運動の寄与および軌道運動と電子スビンの間の相互作用(カップリング)は無視している.
この式は第4周期の遷移元素錯体にはよく当てはまり,これを用いて錯体の不対電子数を求めることができる.
しかし第5,第6周期の遷柊元素およびランタノイド元素には適用できない.
(3)ルイス酸・塩基としての錯体
金属錯体の配位子には中性分子,イオンなど種々のものがあるが,配位原子は全て非結合電子対をもち,配位する時はそれを中心イオンの側に向けた立体配置を取っている.
すなわち,次のような関係が成立している.
中心イオン Co3+←:NH3配位子
電子対受容体 電子対供与休
(ルイス酸,アクセプター) (ルイス塩基,ドナー)
(ルイス酸・塩基については第4回参照)
水和イオンを姶め,今まで扱ってきた錯体(ウェルナー型錯体)は全てこのような形で結合を近似することができる.
中心イオンや配位子の種類によってはこのような関係だけでは律し切れない錯体もあるが,(非ウェルナー型錯体,第18回参照)それらは別の関係が加わるのであって,ルイス酸・塩基的関係は保持されている.
(4)配位結合の分子軌道法による近似
中心イオンと配位原子との間に働く力は,静電的な要素と共有桔合的要素を合わせもっている.
ここでは遷移元素イオンを主として考察しよう.
正電荷をもつ中心イオンが陰イオンまたは分子の負中心である非結合電子対と静電引力を及ぼし合うことは理解しやすい.
一方,中心イオンの外側にあるs,p,d軌道は配位原子の非結合軌道との間に重なり合いが可能である.
これをLCAO法分子軌道として画いてみると図11-6のようになる.
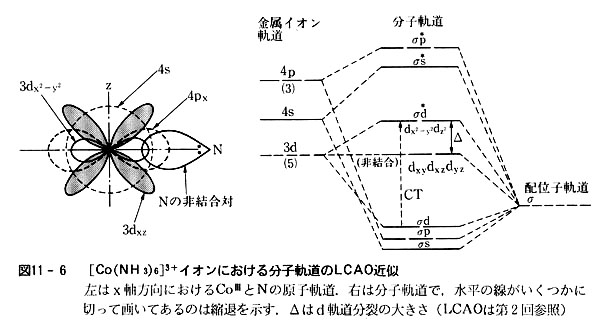
(d電子軌道の形は図1-1,LCAO法分子軌道については図2-1参照)
d軌道にはp軌道と同方向(x,y,zの3軸方向)に拡がる2本dx2-y2,dz,(dγと呼ぶ)及び各軸の二等分線方向に拡がる3本dxy,dxz,dyz(dε )がある.
6配位正八面体構造の場合,前者は配位原子から供与される非結合軌道と向き合うことができるので,s,p軌道と共に分子軌道形成に参加することが可能である.
ここで生まれた結合性軌道は配位原子の軌道としての性質が強く,反結合軌道は中心イオンの軌道的性質が強い.
これに対し,dε軌道は配位原子の供与した非結合軌道とは直接向き合わないので,分子軌道形成には参加せず,錯体の非結合軌道となる.
すなわち中心イオンのd軌道エネルギーは2組に分裂することになる.
電子はこれら軌道のうちエネルギーの低いほうから順次入ってゆく.
配位結合に参加しうる電子の数は,6配位錯体の場合6個の配位原子からの12個に中心イオンの電子が加わる.
遷移元素イオンの場合s電子はイオン化に際し失われており,d電子が問題となる.
6配位正八面体以外の構造をもつ錯体においては,配位原子の非結合対と中心イオンとd軌道との位置関係により,d軌道の分裂のし方は異なる,
(5)分子軌道へのd電子の入リ方
電子が軌道を占める原則は次のように要約される.
(1) エネルギーの低い軌道に優先的に入る.
(2)エネルギーが同じか極めて近い場合は電子スピン が平行になるように入る.(フン卜の法則)
図11-6では配位電子からきた12個の電子はちょうど6本の結合性分子軌道に納まり,中心イオンのd電子が非結合軌道および反結合性軌道を占める.
非結合軌道と反結合性軌道(6配位八面体ではdεとdγ)のエネルギー差が大きい時は原則(l)が優先するが,差が小さい場合は原則(2)が優先する.
d電子数が0~10の各場合について,両方の場合を表示すると図11-7のようになる.
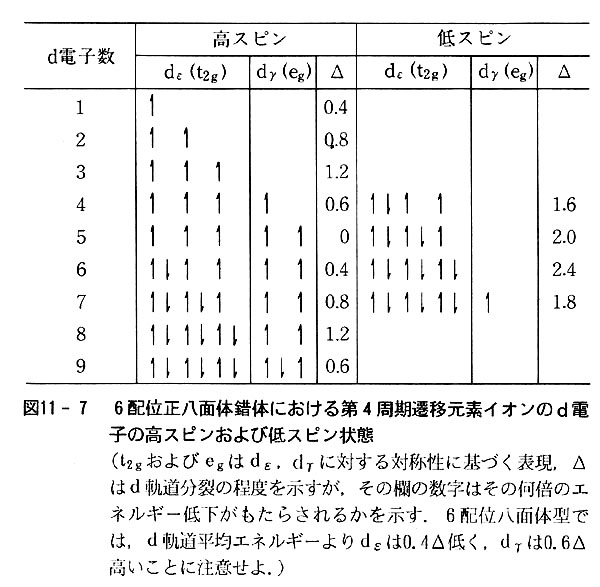
原則(l)が優先する場合を低スピン配置,原則(2)が優先する場合を高スピン配置と呼ぶ.
低スピン型になるか高スピン型になるかは dε軌道とdγ軌道のエネルギー差,つまりd軌道分裂の程度(△)によるが,それを決定する要素は中心イオン,配位子それぞれの側にある.
中心イオン:イオン価の高いほど,また周期表の同族では原子番号が大きいほど低スピンになる.
配位子:分光化学系列上位の配位子ほど低スピンになる.
分光化学系列は可視および近紫外吸収スペクトルの測定から経験則として得られた順列で,配位原子に応じてほぼ次の順序となる.
炭素(CN-) 〉窒素(NO2,NH3,NCS-) 〉酸素(H2O,OH,オキソ酸,有機カルボン酸イオン) 〉フッ素 〉塩素 〉臭素〉ヨウ素 (11.16)
この系列で上位にある配位子ほどd軌道を分裂させる程度が大きい.
同一の配位原子でも配位子の分子構造によって順序は変化し,有機化合物を含めて考えると酸素と窒素の間には入れ替わりもある.
正四面体型においてはd軌道分裂の程度は小さく,ほとんどすべての場合高スピン型となる.
平面四角形型をとる錯休はほとんどすべてd電子8個の系で,それらは4対となって下の4本の軌道を占め,一番上のdx2-y2だけが空軌道となる.(これら錯体はすべて反磁性)
(6)各種金属元素錯体の磁性
多くの金属イオンが与える6配位正八面体錯体について観測された性質をこの考え方で説明してみよう.
d電子数1,2,3および8,9, 10の場合は低スピン・高スピンの区別はなく,電子配置は一義的に決まってしまう.
2価・3価のバナジウム,3価のクロム,2価ニッケル,2価の銅はそれぞれ不対電子数3,2,3,2,Ⅰに対応する磁気モーメントをもつ.(表11-2)
d電子数4,5,6,7の場合は両種の配置が可能である.
2価の陽イオンはd軌道を分裂させる力が弱いので,鉄(d6)やマンガン(d5)の錯体では分光化学系列の最上位を占めるシアン化物イオンの錯体だけが低スピン型をとる.
8価陽イオンはその力が強いので,コバル卜ではハロゲン化物イオン以外の配位子をもつ錯体は低スピン型であり,さらに原子番号の大きい口ジウム・イリジウムの8価陽イオンでは全ての錯体が低スピン型を取る.
これらd電子6個の系では低スピン型は反磁性になる.
(7)吸収スペクトルの説朋
遷移元素化合物には色をもつものが多い.
錯体の吸収スペクトルはそれぞれが特色あるパターンをもつ.
例えば2価銅イオン錯体は可視部に極大1個をもつ吸収スペクトルを与える.
また2価ニッケルの錯体は可視部から紫外部にかけて3個のε<100の吸収ピークを与える.
これらを解析すると中心金属イオンと配位原子の間の結合に関与する電子の状態を理解できる.
まず詳細な研究がある3価コバルトイオンの錯体を例にしてデー夕を整理してみよう.(図11-8)
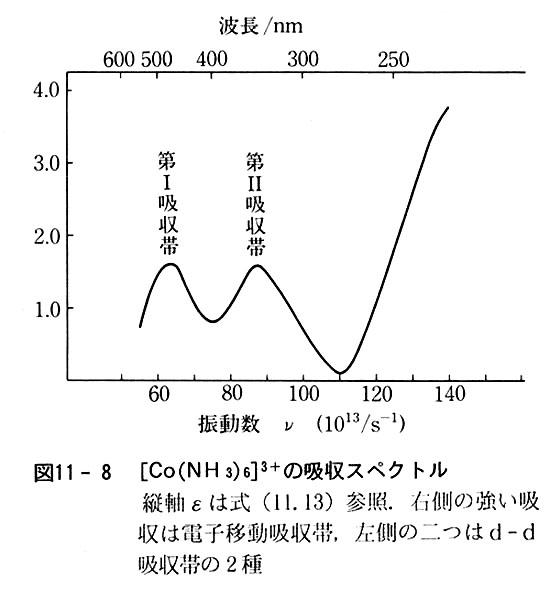
a)可視部から近紫外部にかけて2個の弱い吸収帯をもつ.(ε≧102)
b)より短波長の紫外部に強い吸収帯をもち,(ε≧104)
長波長側の裾が可視部におよぶこともある.
可視・紫外領域の電磁波吸収は電子の遷移によって生じるが,a,bの結果は図11-6に基づいて説明される.
a)の吸収はd-d吸収帯と呼ばれるが,dε軌道にある電子がdγ軌道に移る時の光エネルギー吸収に対応する.
同一中心イオンの錯体においては,この二つの電子軌道エネルギー差は配位子の分光化学系列上の位置によって決まり,上位の配位子を持つ錯体ほど分裂が大きく,従って短波長の光を吸収することになる.(式11.16)
コバルト(Ⅲ)と同族のロジウム・イリジウムにおいてはこの分裂はきわめて大きく,分光化学系列の下位にあるハロゲン化物イオンの錯体においてさえd-d吸収帯は紫外部に移り,これらイオンの錯体はすべて無色か,ごく薄い黄色を示すにすぎない.
他の有色錯体についても以上の考察はあてはまる.
d軌道分裂を起こさせる力の弱い2価銅,2価バナジウム,2価ニッケル等の錯体は青,緑などの色をもつが,これらのd-d遷移は長波長の赤・橙色ないしは赤外部の光吸収によって起こされる.
(d-d遷移の光吸収が弱いのは,この吸収を引き起こす電子遷移が選択律の上からは禁制遷移であるためである.)
b)の強い吸収は電荷移動吸収と呼ばれ,図11-6の結合性分子軌道にある電子が,非結合性のdγ軌道または反結合性分子軌道に移る事によって起こる.
結合性分子軌道は配位原子との相互作用の著しい軌道であり,非結合・反結合の軌道は中心イオンとの相互作用の大きい軌道であるから,この遷移は電子が配位子的軌道から中心イオン的軌道に移ったことを意昧する.
電荷移動と呼ばれるのはこの理由による.
この電子遷移は選択律の上から許容されており,遷移が起こりやすく吸収は強い.
電荷移動吸収がどの波長で起こるかは,配位子の電子がどのくらい中心イオンに引っ張られやすいかによる.
すなわち,分極率の大きい配位子を持つほど,また中心イオンの電価が高く,イオン半径の小さいほど(分極能の大きいほど,第8回)吸帯は長波長にずれる.
ヨウ化物イオン,臭化物イオン,硫化物イオン等の錯体は可視部にまで裾野の広がった吸収をもつが,分極率の小さい水やアンモニア錯体の吸収は200nm位の紫外部にあり,通常の分光器では観測できないこともある.
(8)各種金属化合物の色
遷移元素化合物の着色の原因は以上の考察でかなり明らかになった.
しかし色をもつ化合物は遷移元素化合物に限らない.
例えば,典型金属元素である鉛,水銀,カドミウムなどは多くの着色化合物を与えるし,非金属元素の化合物にも色をもつものが少なくない.
着色の原因は可視部に吸収帯をもつことにあるが,吸収帯を生じる原因は,可視部の光エネルギーに相当するエネルギー差をもった電子軌道が存在し,エネルギーの低い軌道は何個かの電子で占められ,高いほうの軌道には空席があり,その間に遷移が可能であることが必要条件である.
このような条件は色々の電子軌道により満足されるが,主な場合は次のとおりである.
a) d-d遷移
b) 電荷移動(CT) (以上は上述)
c) π-π遷移(有機芳香族化合物に多いが,オキソ酸をはじめ無機非金属化合物やイオンにもみられる.)
d) f-f遷移 f軌道の分裂に基づく電子遷移でランタノイド元素化合物に特有(第14回)
このうちb,cの遷移は多く紫外部に生じ,その長波長側の裾野が可視部に延びるために着色の原因となる.
裾野が紫色の領城まで延びれば黄色,青色までならば褐色から赤色,緑・黄色領域まで延びれば褐色,さらに長波長部まで及べば黒っぽくなる.
実際この原因で起こる着色はこのような色調のものに限られ,長波長部を吸収して短波長部を透過させる青・緑などの色を示すことはまれである.
典型金属元素や非金属元素の着色化合物では黄,赤,褐色系統の色が圧倒的多数を占める.
これに対し,d-d遷移が原因となる時は色々の色調のものが可能である.
遷移元素化合物に着色した物が多いというのはこの事を表現している.
(9)他の性質との関連
d軌道の分裂を考えると,遷移元素錯体の色々の性質が説明できる.
このことはしかし,配位結合がイオン的であるか,共有桔合的であるかという問題と直接にはつながらない.
吸収スペクトルと配位結合の性格との関係を論じるには電子雲拡大効果という別の要素を導入する必要がある.
一方,錯体の置換反応の速さはd電子数やスピン状態とかなり密接な関係にある.
6配位正八面体型ではd電子8個の錯体(3価クロム錯体が代表例)と低スピン型の錯体が置換不活性であり,平面四角形錯体も置換不活性になる傾向が著しい.
正四面体型はほとんど全て置換活性である.
しかし詳細に論ずるためには置換反応─ルイス酸・塩基反応─の機構を考慮した考察が必要である.
錯体の安定度とd軌道の分裂の大小とは直接関連しない.
資料提供 東京工業大学総合理工学研究科助教授 石黒慎一
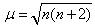 (11.14)
(11.14)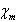 とμは
とμは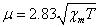 (11.15)
(11.15) はmol-1単位)
はmol-1単位)

