3.希土類元素の分離
(1)分離の困難さ
3価イオンとなった時の希土類元素は性質が互いによく似ているけれども,原子としての性質が直接反映する磁性や光吸収の性質は個々に異なっている.
したがって先端材料としてある希土類元素を利用しようとすれば,他の希土類元素から分離し,純粋にする必要がある.
希土類元素は自然界にリン酸塩,ケイ酸塩として,あるいは他の遷移元素との複酸化物として産出する.
それを硫酸などで処理して水溶液とし,まず他の金属元素を分離する。
得られた希土類元素3価イオン水溶液を再結晶,分別沈澱などの方法で相互分離を行おうとしても,何千回と繰り返さなくては純粋にすることができない.
希土類元素発見の歴史を読むと,何年という桁の長い時間をかけて,一万回再結晶を行っても純粋にならなかったという話もある.
このように希土類元素の相互分離はきわめて困難である.
(2)類似した陽イオンの相互分離
水溶液中の金属イオンを分離するときに,溶解度の差を利用する例については第10回(p.158)で学んだ.
しかし溶解度差の小さい場合にはこの方法は応用できない.
性質の類似したイオンを分離する目的で開発された方法にイオン交換法と溶媒抽出法がある.
a. イオン交換法
イオン交換樹脂というのはポリスチレンなどの有機高分子鎖に官能基を導入し,陽イオンまたは陰イオンと強固に結合するようにした高分子化合物である.(図14-4)
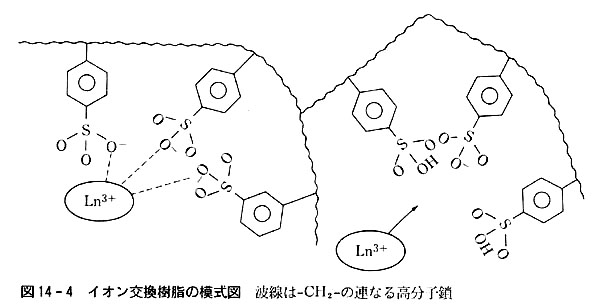
金属元素の陽イオンと結合させるには,スルホ基─SO3Hを高分子の側鎖とした樹脂粒を用いる.
これをガラス管につめて樹脂柱(カラム)をつくり,金属イオンを含む溶液を流すと,スルホ基と反応して金属イオンが樹指につき(交換吸着),相手の陰イオンとH+イオンが流出する.
一般にイオン価の高い陽イオンほどつきやすい.
樹脂柱に種々の溶液(溶離液)を流して陽イオンを流出させる.
例えば塩酸,硫酸などの酸を流すと,樹脂に弱く結合しているイオンがまず流れ出る.
酸の濃度をだんだんに高めた溶離液を順に用いると,樹指との結合力の小さいイオンから順に溶かし出すことができ,分離の目的が達せられる.
b. 溶媒抽出方法
水と混ざり合わない有機溶媒に配位子を溶かし,金属イオンを含む水溶液と振り混ぜる.
金属イオンが配位子と結合して錯体をつくり,それが水よりも有機溶媒に溶けやすい場合は,金属イオンを有機溶媒相に移すことが可能である(図14-5).
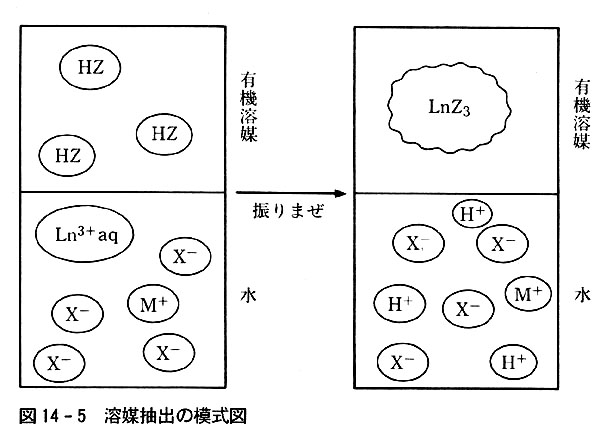
この時の配位子としては,金属イオンと安定な錯体をつくりやすく,生成した錯体が有機蝕媒に溶けやすいことが必要である.
有機キレー卜配位子が多く用いられるが,特に無電荷の錯体を生ずる場合が有利である.
適当な配位子を選び,水溶液のpHを変えたり,有機溶媒の種類を変えたりして,特定の金属イオンだけを有機相に移す方法は金属イオンの分離・精製に広く用いられる.
(3)希±類元素の相互分離─イオン交換法
3価希土類イオン水溶液を陽イオン交換カラムに流して交換吸着させる.
次にキレー卜試薬EDTAの水溶液を溶離液として流す.
EDTAは6座配位子として希土類イオンと−1価の陰イオン錯体を形成する.(Lnは希土類元素,図11-5,p.170).
Ln3++edta4-+nH20=[Ln(edta)(H20)n]-(14.1)
この化学平衡の平衡定数は他の金属イオンに比べかなり大きく,反応速度は大きい.
希土類元素相互間での平衡定数の差は小さいが,57Laから71Luに向かって順次増加する.(図14-3)
イオン半径が小さくなるにつれて増加するわけである.(p.169)
式(14.1)右辺の錯陰イオンは陽イオン交換樹脂と親和性はないから,樹脂から離れて流下するが,EDTAと錯体を形成しやすい希土類イオンほど先に流下する.
つまり原子番号最大のルテチウムから原子番号の逆順序に流下する.
(スカンジウムが含まれていれば,Scがまず流下する.)
EDTAを含む溶離液の濃度やpHを変化させ分離を進める.
カテム1本の操作では分離が不完全なので,多くのカテムを直列につないで交換吸着させ,EDTAを含む溶離液で時間をかけて溶離し各金属イオンが純粋に得られるまで繰り返す.
イオン交換法は小規模な操作でも分離が可能なため,実験室での分離方法として便利であり,またきわめて純度の高い希土類イオンを得るために優れている.
イオン交換法の実際と、装置の写真を映像で見よう.
(4)希士類元素の相互分離─溶媒抽出法
この目的に用いられる配位子としては長い炭素原子の鎖をもつリン酸エステルがよい.
その1種,ジ(2-エチルヘキシル)リン酸(D2EHPA,HZ)は
二量体(HZ)2として存在し,式(14.2)のように反応する.(aqは水溶液,orgは有機溶媒)
D2EHPA=(CH3(CH2)3CH(C2H5)CH2O)2P=HZ
Ln3+aq+ 3(HZ)2org =[Ln{HZ2}3]org+ 3H+aq
(14.2)
この時の反応は速く,水溶液のpHが高いほど式(14.2)の平衡は右に偏る.
pHを調節することによりD2EHPAと結合する強さの違った希土類イオンを有機相に取り出す.
溶媒抽出法は大規模な操作に適し,しかも図14-6のような装置(向流抽出法)をいくつもの装置を組合せて用いることによって,連続的に操作することが可能となるので,工業的な方法として優れている.
資料提供 東京大学物性研究所教授 武居 文彦
明治大学理工学部教授 鈴木 康推


