3.いろいろの分子
(1)単体の同素体
ハロゲン元素および水素・酸素・窒素の単体は2原子分子である。
このうち酸素だけにはオゾンO3という割に安定な別の単体(同素体)がある。
しかし,他の元素でも電荷を持ったイオンには比較的安定なものがある。
例えば,水素はH3という分子を作らないが,H3+は正三角形を持ち真空中ではかなり安定である。
この時は3中心2電子結合という通常の共有結合とは違った結合が考えられる。
このイオンはさらにH2と結合してH5+(鼓形),H9+などの付加物も生まれる。(図3-5)
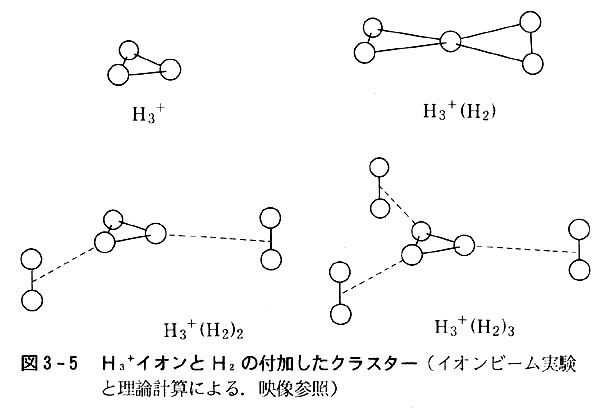
窒素にはN5+,N3−の直線形イオン,ハロゲン元素でもヨウ素にはI3−イオン(直線)が存在する。
このうち,N3−イオン(アジ化物イオン),I3−イオン(三ヨウ化物イオン)などは水溶液中でも安定だが,他は真空中でだけ安定である。
それらの結合エネルギーや生成平衡定数などを調べるには,高度な真空中でイオンと気体を衝突させて生まれる付加物を,質量分析計を用いて測定する方法―イオン-分子反応法―を用いるなど特殊な方法が必要である。
このような研究の行われている状況や,研究の結果は映像によってみることにする。
(2)分子の幾何異性と内部回転
エチレン(図3-2)のH原子2個をCl原子2個で置換すると,三種の異なった分子が生まれる。
a,b;a,c;a,dに置換が生じた場合は別種分子となり,それぞれ1,1-ジクロロエチレン,cis-1,2-ジクロロエチレン,trans-1,2-ジクロロエチレンと呼ぶ。
これらを異性体と総称し,a,bと他の2種を位置異性体,a,cとa,dとを幾何異性体という。
これらは物理的化学的性質が異なり,例えば沸点はそれぞれ31.7,60.3,47.5℃である。
これはC=C二重結合があるため,C-C軸周りに回転するには大きいエネルギーが必要となり,沸点程度の温度では回転せず,3種は別種の分子となる。
これに対しC-C単結合の時は,その軸周りの回転はほぼ自由で,例えば1,2-ジクロロエタンには別々に取り出せる幾何異性体は存在しない。
しかしC-C軸周りの回転は全く自由なわけではなく,回転の途中にいくつかの安定な位置がある。
そういう回転を束縛回転といい,回転スペクトルのシュタルク効果(p.36)またはラマンスペクトルの剛定により,図3-6のような内部回転のエネルギーが求められる。
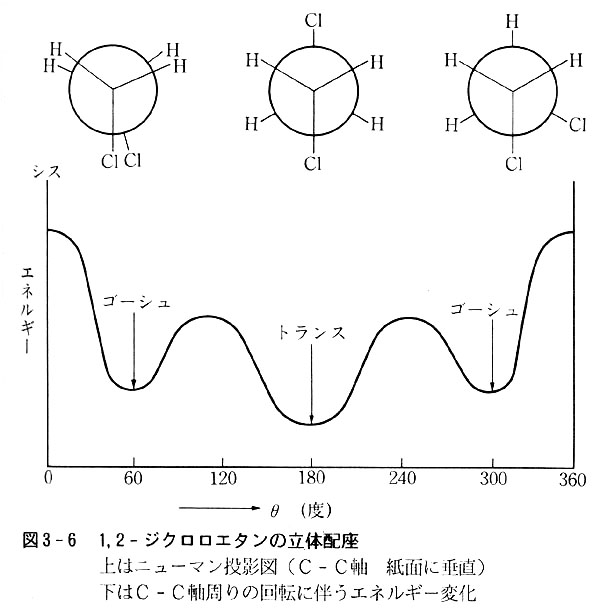
この化合物のC-C軸を紙面に垂直に置いた時,炭素原子上のH,H,Clはお互いにほぼ120°の角度で投影される。
もしC-C軸周りの回転が完全に自由ならば,2つの炭素上の3原子の相対的位置がどうであっても分子のエネルギーには変化がないはずである。
実際は図示のようにエネルギーの山と谷に対応して安定な位置と不安定な位置とがある。
しかしその差は10kJ mol-1程度であるため,室温程度では各異性体を分離できない。
炭素原子上の原子や基が大きい時や,低温では分離が可能となることもある。
このような原因で生まれる異性体を回転異性体,各原子の空間配置を立体配座と呼ぶ。(第2回の映像参照)
通常の条件で化合物の性質や反応を考える時は回転異性体のことは考慮しなくてよい。
しかし,炭素・窒素・酸素などの原子が長い鎖を作る時,環を作る時には回転異性体が重要な意味を持つこともある。
例えば,生体内でアミノ酸残基がペプチド鎖を作ったり,DNAが螺旋構造をとる時はC-N,C-C軸周りでは特定の配座がとられる。
生体機能性物質の構造を決定する要素としては分子内の束縛回転と水素結合(第4回,p.63)が大きな意味を持つ。
(3)窒素と硫黄で生じる化合物
窒素の硫化物には色々の種類がある。
図3-7には2,3の例を示した。これらの中には芳香族性を示すものがあり,窒素原子1個から1個,硫黄原子1個から2個のπ電子が生じるとするとヒュッケルの法則が成り立つという。

ポリチアジルは(NS)xで表される高分子物質(第6回)であるが,黄緑色の金属光沢を持つ固体で,金属性電気電導を示し,低温では超電導体ともなる。
N-S-N-S-の長いジグザグの鎖が束ねられたような構造を持ち,鎖と鎖の隙間には他分子が挟まれることもある。
(4)水素化ホウ素
ホウ素は周期表の孤児といわれるくらい独特の性質を持つ。
単体はB12の二十面体からなり,化合物にも特殊な構造・結合・性質を示すものが多い。
図3-8には2,3の水素化物の構造を示した。
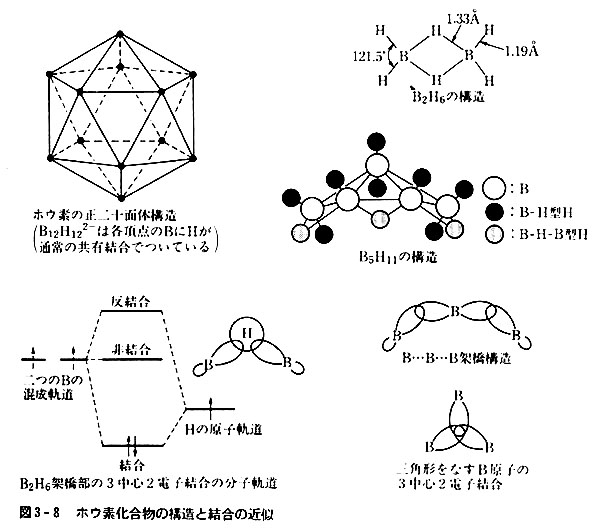
原子の電子配置から予想されるBH3は存在しない。
構造は一見不規則にみえるが,B12H122-という正二十面体の安定なイオンを基本にとり,その一部を切り取った構造を持つと考えると構造を理解できる。
(水素原子は各ホウ素原子に1個ずつ法線方向に通常の共有結合で結合している。)
BとHの間には独特の3中心2電子結合が存在する。
最も簡単なB-H化合物であるジボランB2H6は図のような構造を持ち,通常の共有結合を考えたのでは電子数が足りない。
BBHの3原子が2個の電子で結ばれるとすると,図のような分子軌道を画くことができる。
そのほか3個のB原子が2個の電子で結ばれる結合もある。
水素化ホウ素は極めて酸化されやすく,そのとき大きい反応熱を発生するのでロケット燃料に用いられる。
資料提供 山梨大学工学部教授 平岡 賢三



