4.水と酸・塩基
水は物をよく溶かす液体であるが,その性質はかなり独特である。
酸と塩基は日常生活にも関係深く,水溶液の特色の一つである。
(1)水の特色
水は種々の特色を持った液体である。
分子量が小さい割に融点・沸点が高いことは水素結合のためであることは先に述べた。
また多種類の物質をよく溶かすことも特性の一つであるが,これは誘電率が大きい(比誘電率で約80)ことと関係が深い。
構造的には水は氷と水蒸気の中間に当るが,氷の方にずっと近い。
このことは水の気化熱(40.6 kJmol-1)に比べ,氷の融解熱(6.0 kJmol-1)は著しく小さい事実からも理解される。
水の構造は氷の構造が部分的に崩れた形であるといわれるが,これをもう少し厳密にみると図4-5のようになる。
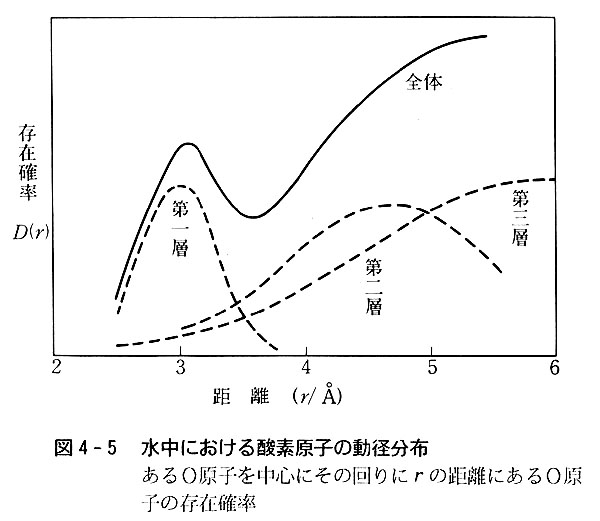
一つの酸素原子に着目して,その最近接酸素原子はかなり規則正しい位置にあるが,遠ざかるにつれて種々の距離に存在するようになる。
つまり,∠OOOが正四面体角からずれているので,遠くに行くに従ってO-O距離は一様でなくなる。
氷はH2O分子が水素結合でつながって生じた集合体であるが,水素結合のエネルギーはO-Hの共有結合に比べれば著しく小さいので,常温の熱エネルギーでも切れたり弱まったりして,∠OOOがかなり変化し,その結果として第2層以遠ではO-O距離が変わるわけである。
(2)水の自己電離
氷の結晶中にはイオン欠陥があって,氷の電気電導に寄与しているが,液体の水になっても,H3O+やOH−のようなイオンが生じていて,これが水の電気電導の原因になっている。
できる限りの努力を払って精製した水でも,26℃で6.30×10-8Scm-1(Sは導電率の単位シーメンス,1S=Ω-1)という電導度を示し,それは水の自己電離によることがわかった。
2H2O H3O++OH− (4.2)
H3O+はヒドロニウムイオンまたはヒドロキソニウムイオンと呼ばれ,水分子にH+イオンが結合したものである。
式(4.2)の電離平衡の平衡定数は
K=[H+][OH−]/[H2O] (4.3)
で示される。
水の濃度に比較すると,両イオンの濃度はごく小さく,水濃度を一定とすることができ,
Kw[H2O]=P=[H+][OH−] (4.4)
Pを水のイオン積と呼ぶ。
25℃で次の値をとる。
P=1.008×10-14mol2dm-6
電荷中和の原則により,[H+]=[OH−]であり,
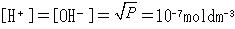 (4.5)
(4.5)
となる。
この値を対数で示したのがpHであり,中性の場合はpH=7.0となる。
これより大きいpH値は[H+]の多いことつまり酸性を表し,小さいpHは[H+]が小さく[OH−]の大きい塩基性を意味する。
(3)酸と塩基
理科学習の初期においては,酸とアルカリ(塩基)を現象としてとらえ,溶液の味とかリトマス試験紙の変色で定義した。
その後,これを溶液中に存在するイオンの種類と結び付け,水素イオンH+を与える物を酸,水酸化物イオンOH−を与える物を塩基とした。
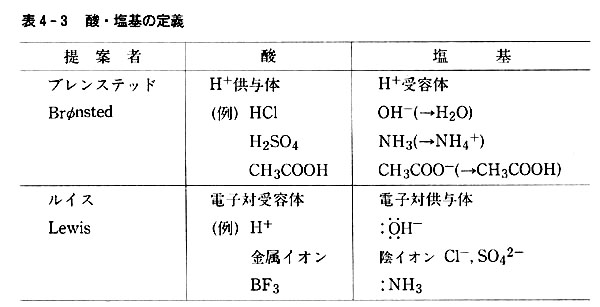
これを拡張し,水素イオンを与える物を酸,水素イオンと結合してその特性を失わせる物を塩基と定義したのはブレンステッドである。
この関係を表4-3に示した。
H+は水中では常に水分子と結合してH3O+として存在する。
酸と塩基が同じ物質量(モル数)だけ存在すると,式(4.2)の化学変化が左向きに起こってH3O+とOH−は消滅し,酸・塩基の性質はみられなくなる。
これが中和である。
酸・塩基の性質を分子の立場でみると,OH−イオンは非結合電子対3個を持ち,それを他に与えやすい。
またH+は非結合電子対を持たず,他の原子や分子の持つ非結合電子対を受け取る傾向が大きい。
例えば,図3-1に例示したアンモニアは非結合電子対1個を持ち,これをH+に与えてアンモニウムイオンNH4+を生じるが,これは一種の中和と考えてもよいわけである。
ルイスはこのように考えて,酸・塩基の新しい定義を与えた。
この関係と実例を表4-3に示した。
電子対の授受に基づくこの定義は広い範囲に適用できるので,色々の場合に応用される(錯体における配位結合,p.173)。
(4)酸・塩基の強さ
塩酸はごく希薄な溶液でもpH〜1程度の低い値を示すが,酢酸は濃い溶液でもpH〜3位までしか下がらない。
このような違いは,酸となる物質がH+を与える程度の差によって起こる。
酸は水にあうと式(4.6)のような解離(酸解離)を生じてH+を与えるが,その程度は式(4.7)で示される。
HX+H2O H3O++X− (4.6)
Ka=[H3O][X−]/[HX][H2O] (4.7)
ここでX−は酸の陰イオンである。
式(4.6)の平衡が右に偏っている程多くの水素イオンを与え,Kaは大きくてその酸は強いことになる(塩酸,硫酸など)。
反対に平衡があまり右に寄っていない時はKaが小さいが,水素イオン濃度は低く酸としては弱い(酢酸など多くの有機酸)。
Ka値は10-10程度から1010程度まで広い範囲にわたるので対数で示すのが普通である。
pKa=−logKa (4.8)
塩基の強さも同様にして水酸化物イオンの濃度をどの位増加させるかによって定義できる。
(5)ルイス酸・塩基の強さ
式(4.6)のようにHXの酸解離を考えた時,X−をその共役塩基という。
HXは共役塩基X−がH+をつかまえて生じたとみれるわけである。
HXが強酸であれば式(4.6)は右に寄っており,X−はH+をあまり強くつかまえていないことになる。
HXが弱酸ならばX−はH+を強くとらえているので解離しにくいと解釈できる。
水素イオンであるルイス酸をつかまえる強さ,つまりルイス塩基としての強度は次のように表現できる。
「強酸の共役塩基は弱いルイス塩基,弱酸の共役塩基は強いルイス塩基である。」
ルイス塩基の強さは共役酸のpKaで示される。
式(4.6)をみれば分かるとおり,酸が強い弱いといってもそれは水分子との相対的な強弱をいっているのにすぎない。
水分子自身,非結合電子対を持つルイス塩基であり,式(4.6)は,X−とH2OがH+を奪い合っている状態を表現していることになる。
(6)オキソ酸の強さ
非金属元素の酸化物は水に溶けると酸になるが,これらはオキソ酸と総称する。(p.51)
オキソ酸の強さには大差があり,式(4.6)が完全に右に寄ってしまっているものから(過塩素酸HClO4,硝酸HNO3),pKa が10以上の例まである。(ホウ酸H3BO3,炭酸H2CO3)
それらの間にはかなりの規則性が認められる。
○ 同一元素のオキソ酸では酸化数の高い方が強い。
○ 同族元素の同一組成のオキソ酸のうちでは原子番号の小さい元素の方が強い。
〇 同一周期元素で同じ数の酸素原子を持つオキソ酸のうちでは原子番号の大きい方(右寄りの元素)が強い。
このことは図4-6のように説明できる。
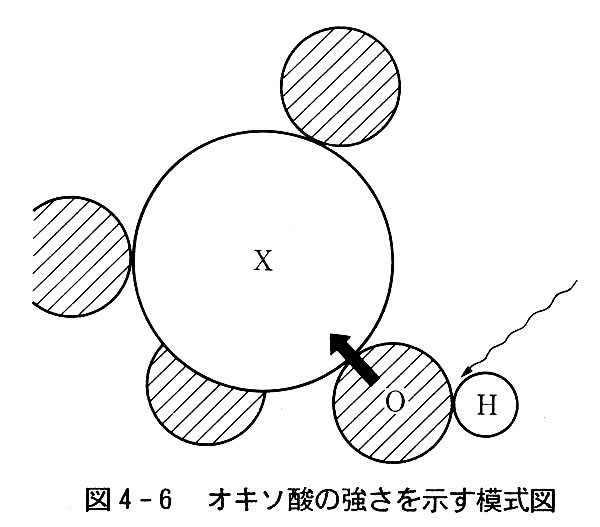
電離する水素原子が酸素原子と結合した-OH結合の部分に電子が多く局在して共有結合が強いほどOHは切れにくく,電離しにくい。
OH部分の電子密度が小さければ切れやすいわけである。
このO原子は,一方では中心にある非金属元素の原子(例えばリン,硫黄,塩素など)とも結合しているが,非金属元素の種類によって電子の引き寄せ方に差が現れる。
中心原子の酸化数が高い程酸素原子の電子はその方に引っ張られ,OH部分の電子密度は低くなる。
そしてOHが切れやすくなり,多くのH+を生じて強酸となる。
また中心原子の電気陰性度が大きいほど,やはり酸素原子の電子はそちらに引っ張られて,強酸となる。
同族元素では原子番号の小さい元素程,同一周期では原子番号の大きい程,電気陰性度は大きいから,上記のような経験則が認められることになる。
資料提供 分子科学研究所長 井口洋夫
国際基督教大学教授
(北海道大学名誉教授) 東 晃

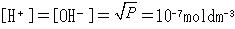 (4.5)
(4.5)
