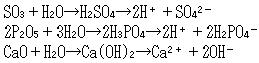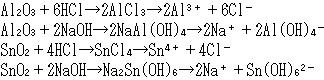3.化合物の特色
本回で扱う元素の化合物もまた,金属元素と非金属元素の中間に当たる特色を示す物が多い。
ここでは特色のよく現れる酸化物とハロゲン化物を取り上げ,主として化学的性質について比較しよう。
(1)酸化物
非金属元素の酸化物はほとんどすべて小分子で,水に溶けたときは酸を与える。(表5-4)
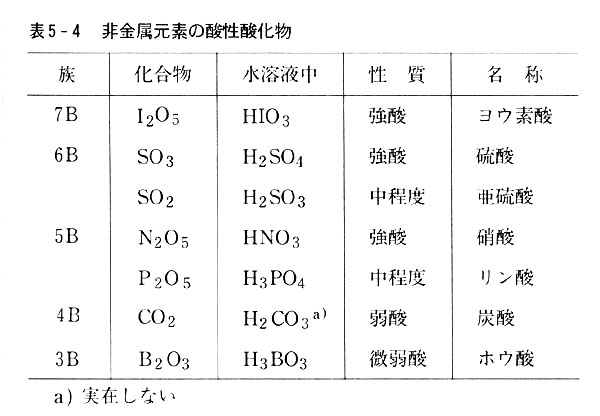
酸の強さは周期表の右に行くほど,また同族では下にゆくほど強くなる。
金属元素の酸化物は多くイオン結晶となり,水溶性の物は水酸化物に変わって塩基性を示す。
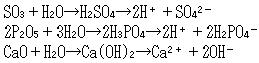
このような理由から,三酸化硫黄や五酸化リンを酸性酸化物,酸化カルシウムなどを塩基性酸化物という。
これに対し,中間領域元素の酸化物は両性を示す。
すなわち,酸に溶かした時は金属元素酸化物のように陽イオンを与えるが,塩基性溶液では非金属元素酸化物と同様陰イオンとなる。
代表的なアルミニウムとスズについて2種類の反応をみよう。(表5-5)

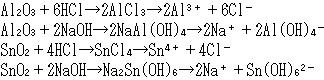
(これらはすべて水の中の反応なので水分子は略した。)
このような両性を示すものはほぼ3B〜5B族の元素に限られ,同族では原子番号の小さいものほど酸性酸化物的であり,大きいものは塩基性酸化物的である。
前者は非金属性の,後者は金属性の現れであるから,この点からも周期表上で,右上に行くほど非金属性が強く,左下ほど金属元素性が顕著だということができる。
(2)ハロゲン化物
塩化物を代表として取り上げる。(表5-6)
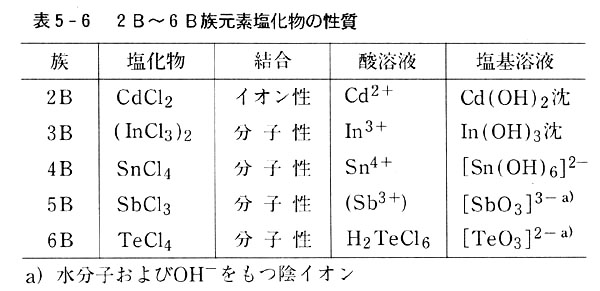
金属元素のハロゲン化物はイオン結晶が多い。
イオン価の高い遷移元素化合物の場合は分子を生じることもあるが(TiCl4,MoCl6等),例外と考えてよい。
水に溶けた時は金属イオンとハロゲン化物イオンに電離する。
非金属元素のハロゲン化物は例外なく共有結合性分子を与え,水にあうと分解する。
これに対し境界領域の元素は共有結合性分子を作るが,水にあうと表のように両性を示す。
資料提供 東京大学物性研究所教授 武居 文彦