5.合金
実用されている金属の大部分は合金である。
合金には金属元素だけを含むもの,金属元素と非金属元素からなるものがあり,構造からみると置換型合金と侵入型合金(介在型合金)の別がある。
合金の状態を考察するには状態図(多相平衡図)が役立つ。
一般に合金の構造には結晶中に歪みが多く,導電率は純金属に比較して低い。機械的性質はかなり大幅に変化する。
(1)置換型と侵入型
金属結晶中の原子の位置に他種原子が代わりに入ったのが置換型合金である。
純金属の造る結晶どうしが同一構造を持つ場合,置換合金中では両種原子は全く不規則に配列している(固溶体ともいう)。
両純金属の結晶構造が同じでも,他の性質―例えば金属結合半径―が異なるときは固溶体を全く生じないか,限られた量比でしか生じないこともある。
大ざっぱな目安として,金属結合半径の差が15%という値が参考になる。
半径が近いほど固溶限界が大きい。半径が1.30Åに近い金属原子(Zn,Ⅴ,Mn)は種々の金属に固溶しやすい。
同族元素ではどんな成分比でも固溶体を造ることが多い。
(例:K-Rb-Cs;Ca-Sr-Baの各相互間)
金-銅系は高温では完全固溶体を作り,急冷するとそのままの状態を保つ。
徐々に冷却すると無秩序構造とはならない。
Cu:Auの原子比1:1の時は立方最密構造の1層おきに,銅および金が規則正しく並んだ層を生じる。
このようなものは金属間化合物という。
侵入型合金においては金属原子の並んだ隙間に他の金属原子または非金属原子が入り込んでいる。
この型の合金を与えるのは4A~6A族遷移元素に限られ,侵入しやすいのは炭素・窒素・ホウ素である。
酸素・ハロゲンなど電気陰性度の大きい原子は入りにくい。陰イオンとなってイオン結晶を作りやすいわけである。
侵入型合金は融点が高く,極めて硬い。
これは方向性のある強固な結合が存在するためと考えられる。
八面体孔に入った炭素・窒素はそれぞれ4個および3個の原子価電子が遷移元素のd電子と共に共有結合にあずかることになり,6個の結合に対して電子対ができるには数が不足で,金属結合的だといえる。
侵入型でも,一定の構造を持つ時は金属間化合物の一種とみなしてよい。
しかし定比化合物となることはむしろ稀で,大部分は不定比化合物となる。
(2)合金の状態図
多相系の状態を支配する基本法則に「相律」がある。
相の数(固相に限らない)p,独立して変化しうる成分数c,系の自由度(独立に変化しうる状態変数の数)fの間には次の関係がある。
f=c+2-p (7.1)
相律についての詳しいことは,「基礎化学」の科目で扱われる。
2成分系についてみると,f=4-pとなり,2相共存の場合でも自由度は2で,温度・圧力をともに自由にとることができる。
(しかし固体では圧縮率が小さいので,1000気圧以上かけないと目立った変化は認められない。)
状態を調べるには横軸に成分比,縦軸に温度を目盛った図表(状態図)を用いるのが便利である。
図7-6には固溶体のできない系,一部固溶体生成系,完全固溶体生成系,金属間化合物生成系の状態図を例示した。
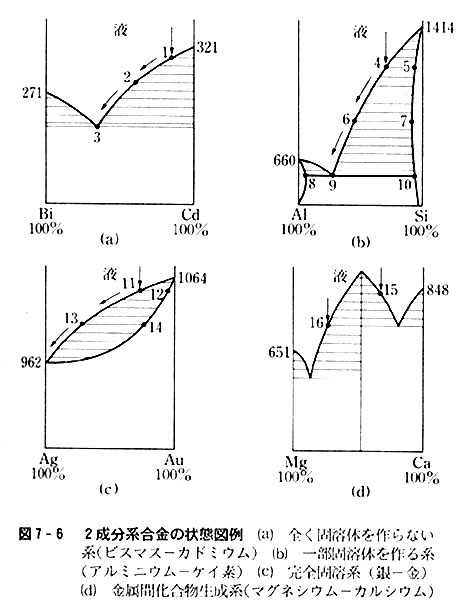
どの図においても横線の部分に対応する相は存在せず,横の線が左右の太い線と交わる点の2相共存状態となる。
一般に溶液は純溶媒より融点が低いが(氷点降下),融解した合金も溶液の一種と考えてよいわけである。
例えば(b)の系では,左方では立方最密構造のアルミニウム中にケイ素が,右方ではダイヤモンド型結晶のケイ素中にアルミニウムが溶けたとみなす。
金属間化合物ができた場合はその融点が成分金属のどちらよりも高いのが常で,(d)図の中央部に極大を生じ,左方と右方にそれぞれ「金属間化合物-成分金属単体系」を考えることになる。
図の縦矢印の成分比を持つ融体を冷却してゆくと,斜め矢印に沿って状態が変わり,数字で示した各点の成分比を持つ固相を順次に生じて,最終的には曲線の極小点(共晶点という)の組成を持つ固相を生成するようになる。
合金の固相は成分比の異なる多くの結晶小粒が集まった集合体なのである。
3成分系になると,組成は正三角形の内部の1点で示される。
しかし,温度・圧力を平面上に示すことはできない。
また自由度はf=5-pとなり,状態図は複雑化する。
状態図は合金に限らず一般の溶液系にも応用され,例えば,電解質溶液からイオン結晶の析出する状態を示すのにも用いられる。
資料提供 東京大学物性研究所教授 武居 文彦
