4.水和イオンの水交換
(1) 実験方法
水溶液中でイオンに水相した水分子はじっと水和したままで静止しているのであろうか。
このことを調べる実験としては,同位体で標織した水分子を用いる方法がある.
酸素の同位180を多く含む水に水和イオンの塩類を溶かし,適当な方法(例えばエタノールを加える)で水和イオンの塩を沈澱させる.
もし,溶媒の水と水和水分子との間に交換が起こっていれば,沈澱した塩にはH2180が多く含まれるはずだから,質量分析計を用いて180の量を調べれば交換の有無が分かるし,放置時間を変えて実験を繰り返せば交換速度も知りうる.
この方法の欠点は実験に時間がかかることで,交換が速い場合には追跡できない。
1分以下で起こる水分子の交換を調べるにはnmr法が用いられる.
酸素のもう一つの同位体170を含むH2170分子が,水和している時としていない時とで異なるnmrシグナルを与える性質を利用し,シグナルの化学シフ卜や線幅の測定値から水和水一溶媒水間の交換速度を求める。
この方法によれば,10-10秒程度の短時間に起こる水分子の交換速度さえ求めることが可能である.
(酸素原子の代わりに水素原子を標識する方法は役に立たない.
水素結合の生成・切断によって,水素原子は隣接分子間に速やかな交換を常に起こしているからである.)
(2)各種陽イオンの水交換速度
上記の方法を色々な陽イオンに適用して得られた水和水一溶謀水間の交換速度を,l mol溶液中での水和水分子の平均寿命(単位s)として示したのが図9-7である.
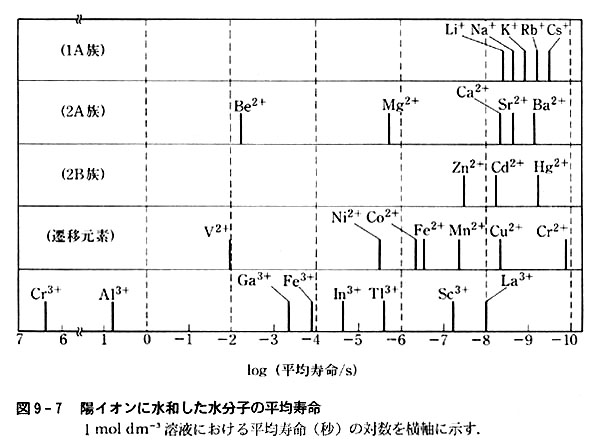
この交換速度は,温度はもとより水溶液のpHその他色々の条件によって変化するから,データは一応の目安とみるのがよい.
図からまず読み取れることは,交換速度が極めて広い範囲にわたることである.
また同一元素でもイオン価により交換速度に大きい差がある.
顕著な例はクロムで,2価と3価のイオンでは交換速度に約16桁の差がある.
これは太陽系が生まれてから今日までの時間と1分間との差に対応する大差である.
一般的にみて,イオン価の高いイオンほど交換速度は小さいが,遷移元素と典型元素,周期表の族によって著しい差がある.
細部をみると,典型元素においては周期表の同一亜族で原子番号が大きいほど速度が大きくなっている.
これらイオンと水和水分子との結合は静電的な力に基づくと考えられるので,原子番号が大きい,イオン半径の大きいイオンほど,結合が弱く,交換しやすいためであろう.
遷移元素ではd電子の関与の仕方によって,必ずしも静電的な結合力だけが働くとは限らす,同一亜族でも構造や結合の強さの異なる水和イオンを生じるからである.
水交換の速度は各陽イオンのつくる錯体の配位子置換速度の目安ともなる重要なパラメーターである.
(3)陰イオンの水分子交換
陰イオンに水和した水分子は水素原子を通していわば間接的に結合している.
特にオキソイオンでは-O…HOHのような水素結合があり,170のnmrシグナルから水和水交換のデ-タが得にくい。
一方,オキソイオンの酸素原子が溶媒水との間に交換をおこす速度は色々の系について測定されている.
その結果は次のように要約される.
ⅰ)同一元素を中心にもつオキソイオンでは酸化数の高いものほど遅い。
(例 ClO4- <ClO3-<ClO2-<ClO-)
ⅱ)同一亜族の同一タイプのイオンでは原子番号の小さい元素の作るイオンの方が遅い。
(例ClO3-<BrO3-<IO3-)
ⅲ)同一周期の原子価電子数の等しい元素のイオンでは,中心イオンの酸化数の高いものほど遅い。
(例ClO4-<SO42-<HPO42-<H2SiO42-)
(4)溶けてゆく過程
電解質が水に溶けてイオン水溶液のできる過程は,式(9.4)以下のサイクルのような段階的なものではなく,イオン結晶の破壊と水和イオンの生成は同時に進行する。
その様子は映像によって示す。
結晶の表面が水に接触すると,表面にあるイオンに水分子が近づき距離が短くなると,静電的相互作用が顕著となり水和状態となる.
こうしてイオンに水和する水分子数が増すにつれ,そのイオンと結晶中の隣イオンとの結合が弱くなり,そのイオンは結晶から離れる.
離れればさらに多くの水分子が水和してきて,結局水和イオンが水分子の中に散在するようになる.(映像参照)
資料提供 東京工業大学総合理工学研究科助教授 石黒慎一
東京工業大学総合理工学研究科教授 岡田 勲
山梨大学工学部教授 平岡賢三
