2.化学反応の分子ダイナミックス
化学反応は,分子同士が相互作用をし,活性化状態を経て反応生成物に至るダイナミカルな過程である.
このように捉えた反応を反応素過程と呼び,それを研究する分野は化学反応の分子ダイナミックスと名付けることができよう.
この分野の実験は大きくいって二つある.一つは分光学的方法で,もう一つは分子線の方法である.
●化学発光
ある種の化学反応においては,反応にともなって放出されるエネルギーは,生成分子の特定の状態に分配され,場合によると光を発する.
これを「化学発光」と呼ぶ.化学発光の反応では,反応エネルギーは熱にならない.
熱は,エネルギーを受け入れ可能な分子の運動自由度にランダムに分配したとき,分子システムのもつエネルギーの一つの形態である.
化学発光のスペクトルを調べると,生成分子がどのような量子状態をとっているかがわかる.
フッ素原子と水素の反応では,134kJmol-1の発熱反応でフッ化水素を生成する.
その反応をF・・H・・Hのポテンシャルエネルギー曲線上の運動として描いたのが図11-4である.
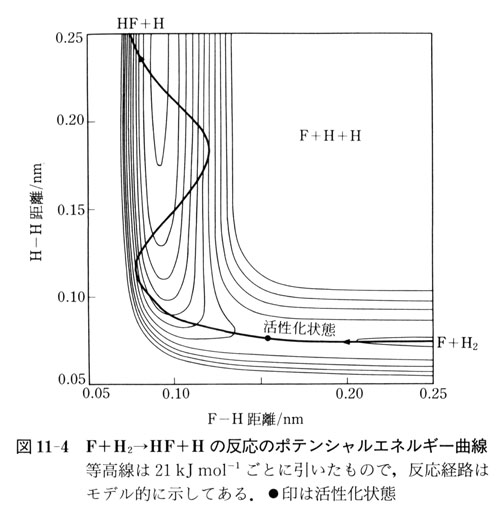
これは,ポテンシャルエネルギー曲面をF-H距離とH-H距離の関数として地図の等高線のように表したものである.
FがH2へ近づく反応初期は右側の浅い谷から反応後期の深い谷へ球がころげこむような経路をとる.
結果として,生成したフッ化水素の結合は伸びたり縮んだりする振動運動を行う.
つまり,反応エネルギーは振動運動自由度に主として分配される.
フッ化水素の振動スペクトルは2.6μmの赤外領域に現れるので,赤外化学発光が起こる.
そのスペクトルを詳しく解析すると,フッ化水素の振動状態や回転状態の分布が決定できる.
この結果は図11-4に示したようなポテンシャルエネルギー曲面の形状や反応のダイナミックスと結びつけて論じることができる.
化学発光をもたらす化学過程を逆にたどることもできる.
化学発光の波長と同じ光を反応生成分子に照射すれば,反応は逆行する.
これは,特定の波長の光の照射によって特定の分子に反応を引き起こす.
これがレーザー誘起化学反応という新しい反応研究の方法を生むことになった.
●交差分子線反応
分子線は気体を真空容器内に噴出させた流れをスキマーと呼ばれるスリットで切りとり,ビームとして一方向へ分子群を一定速度で進行させたものである.
いま,二つの分子線源があり,それらを直交交差させる.
その結果,衝突反応が起こり,生成した分子は,真空槽内へ散乱される.散乱する方向と速度を測定すれば,反応がどのようなメカニズムで起こるかを知ることができる.
図11-5は,F + H2の交差分子線反応の反応分子と生成分子の速度関係を表した図で,ニュートンダイヤグラムと呼ばれている.
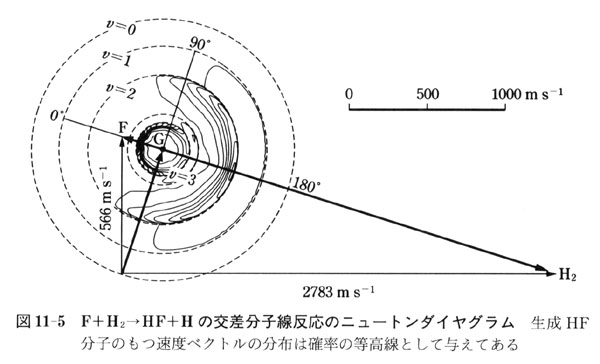
この実験では,F原子とH2分子が7.69kJmol-1のエネルギーで互いに衝突する.F原子とH2分子で質量に差があるからH2分子の速度はF原子のそれに比べてずっと大きい.
F原子とH2分子の相対運動は,その速度べクトルを結んだ線上にある.F原子とH2分子の重心の運動に対してF原子とH2分子の相対運動は,F原子は280ms-1, H2は2620ms-1である.
これに対し,生成HF分子はその振動回転状態によってその速度が違って来る.図11-5では,
F + H2 → HF(v, J = 0) + H
のHFがもつべき速度ベクトルの先端を,重心を中心とした円周上にあるものとして描いてある.
生成HF分子の速度べクトルの先端がその重みに応じて等高線地図のように与えてある.
この等高線地図より振動状態のv = 2とv = 3のHFが主として生成することがわかる.
また,その生成の方向がF原子の進行の方向と逆である.このような散乱を後方散乱という.
このことから次のことが結論できる.
反応の遷移状態はF-H-Hの直線構造に近く,H-H間の結合が切断する反跳でHF分子の振動励起が起こる.
生成分子の散乱角の幅が狭いことから遷移状態の寿命が極めて短いことがわかる.
化学発光や交差分子線の研究方法で,いろいろな反応メカニズムが解明されている.
図11-6にその典型的な場合を示した.
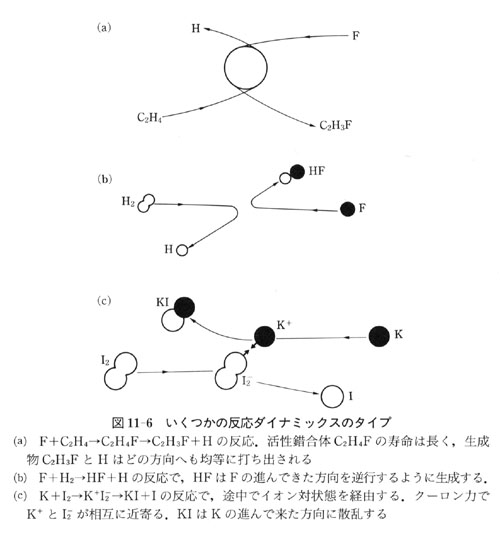
図11-6(a)は反応遷移状態の寿命が長く,遷移状態が回転するために反応物の散乱が等方的となる.
(b)はF + H2の反応のように反応の遷移状態の寿命が短く,反応は直接的な場合である.
(c)は,反応分子間で電子が移動して中間にイオン対状態を経て反応する場合である.
この場合は,反応生成分子は前方散乱となる.
この反応では,電子をもりにたとえて「もり打ち」反応と呼ぶこともある.
以上説明した化学反応のミクロなレベルの実験研究は,化学反応をポテンシャルエネルギー曲面上の運動と考える量子化学理論と結びつき,化学反応の先端的研究の課題となっている.


