4.対流圏の化学
成層圏ではオゾンが減少しているのに対し,対流圏のオゾンは増加している.
いわゆる清浄地域においても対流圏のオゾン濃度は前世紀に比べて2倍以上増加していると言われている.
対流圏のオゾンの起源は2種類あり,一つは成層圏オゾンの対流圏への侵入(成層圏と対流圏の大気は非常にゆっくり入れ替わっている)であり,もう一つは対流圏で生成される光化学オゾンである.
光化学オゾンというのは都市の大気汚染でよく知られている光化学オキシダントと同じで,炭化水素とNOXが太陽光により光酸化反応を起こしその結果生成するオゾンのことを言う.
一例として図13-6に1965年ロスアンゼルスの沿道で測定された1時間毎の大気汚染物質の濃度変化を示す.
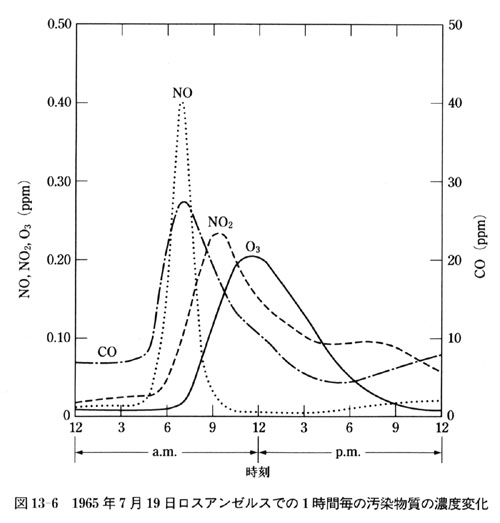
早朝通勤による自動車からの排気ガスによりNOのピークが現れる.
図には示していないが,当然ガソリンからの炭化水素も排出されている.
太陽光が作用して,NOはNO2に変換され,NO2の出現のあと,オゾンが生成される.
NO,NO2,O3の順にピークが遅れて出現する化学反応が典型的な光化学オゾン生成反応である.
NO → NO2の変換はどのようにして起こるのか.
NOを実験室など空気にさらすと褐色のNO2が生成することを知っている人は多いであろう.
しかしこの反応は2分子のNOと1分子のO2の反応であるため,大気中の低濃度(ppm以下)のNOの条件では殆ど起こらない反応である.
NO → NO2の変換が大気中で生成したフリーラジカル(R・)と酸素分子の再結合反応によって生成するRO2ラジカルによるものと決定されたのは今から25年程前のことである.
ここでR・は主に有機化合物のラジカルである.
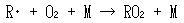 (13.17)
(13.17)
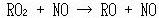 (13.18)
(13.18)
大気中の炭化水素ラジカルは主に大気中のOHラジカルと炭化水素の反応によって生成する.
また対流圏でのOHラジカルは主に対流圏オゾンの光分解によって生成する励起酸素原子,O(1D),と水蒸気の反応により生成する(都市のように汚染された大気中では別の反応で生成する).
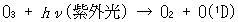 (13.19)
(13.19)
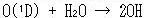 (13.20)
(13.20)
このようにして生成したOHラジカルが,代表的な炭化水素であるプロピレン(C3H6)と反応した際の連鎖反応を図13-7に示す.
この場合,反応の開始において使われたOHラジカルは,反応の終わりで再生するため,何度もくり返し反応することができる.
このような連鎖反応によってNO → NO2への変換が効率よく行われ,さらにNOがNO2に変換された後,NO2は太陽光の紫外線で光分解する.
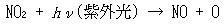 (13.21)
(13.21)
生成した酸素原子は大気中の酸素分子と再結合してオゾンが生成される(反応13.2).
以上が対流圏におけるNO → NO2 → 03変換のあらましであり,光化学オゾンの生成機構である.
対流圏大気中のOHラジカルはO.1〜0.01 pptと非常に低濃度であるにもかかわらず光化学オゾン生成に寄与しているのはその反応が連鎖反応であるからである.

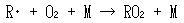 (13.17)
(13.17)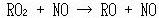 (13.18)
(13.18)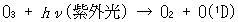 (13.19)
(13.19)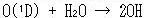 (13.20)
(13.20)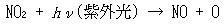 (13.21)
(13.21)