3.物質の化学結合エネルギー
●結晶の格子エンタルピーと水和エンタルピー
塩化ナトリウムのような結晶を構成するイオンをばらばらにするのに必要なエンタルピーを格子エンタルピーという.
その値は生成エンタルピーと構成イオンに関連するいろいろな反応過程のエンタルピー差から求められる.
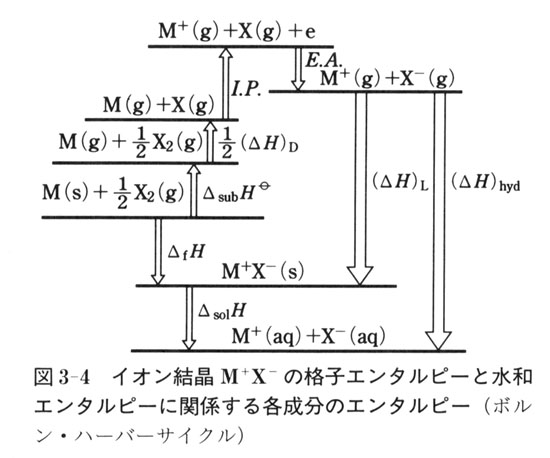
図3-4にそのエネルギー関係を示した.生成エンタルピーは,次の五つの反応過程のエンタルピー差の和で表される.
1) 固体金属の昇華による金属原子の生成エンタルピー 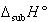
2) ハロゲン分子の解離エンタルピーの半分 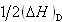
1 金属原子のイオン化ポテンシャル 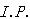
2 ハロゲン原子が電子1個をとり込み,気体ハロゲンイオンに変化する電子親和力 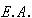
1) 気体イオンから結晶を生成する格子エンタルピー 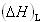
これらは一つのサイクルを構成し,ボルン・ハーバー(Born-Haber)のサイクルとして知られている.式で表すと,
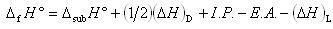 (3.12)
(3.12)
となる.
この式より格子エンタルピー以外のエネルギー項が与えられれば,その値を定めることができる.
また,結晶の溶解エンタルピー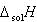 がわかっていれば,気体のイオンから水溶液中のイオンへの変化にともなうエンタルピー変化
がわかっていれば,気体のイオンから水溶液中のイオンへの変化にともなうエンタルピー変化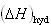 を求めることもできる.
を求めることもできる.
イオンは水溶液中で,多くの水分子に囲まれた水和(hydration)状態にある.
したがって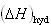 を水和エンタルピーという.表3-2に,いくつかのイオン結晶について格子エネルギーと溶解エンタルピーの値を示した.
を水和エンタルピーという.表3-2に,いくつかのイオン結晶について格子エネルギーと溶解エンタルピーの値を示した.
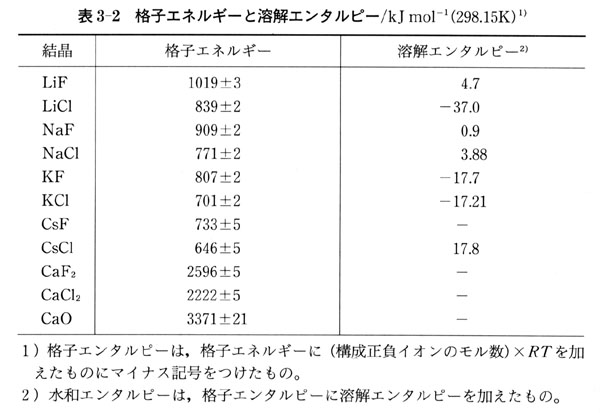
表3-2の格子エネルギーを見ると,LiFを除くと1価の正負イオンから構成される結晶の格子エネルギーに大きな差はない.
それは,イオン間の距離がLiFの場合小さいのに対し,他のイオン結晶では大きな差がなく,クーロン力が格子エネルギーの原因となっているからであろう.
また,2価のイオンの結晶はクーロン力が強くなるため格子エネルギーは1価イオンに比べてずっと大きくなる.
溶解エンタルピーはイオンの水和状態の安定さを反映して,イオン結晶によってかなり違っている.
KCl,KF,LiClの水和エンタルピーは,格子エンタルピーよりも負に大きくなっており,これらの結晶の水和性が大きいことを物語っている.
●共有結合エネルギー
分子を構成する原子の気体状態の生成エンタルピーが求められれば,分子の中の結合原子対を解離するためのエンタルピーがわかる.
実際には,逆に,解離エネルギーを求め,それから,原子の生成エンタルピーを決定している.
何故なら,原子は反応活性に富んでいるからそれを熱力学の測定の対象として扱うのは容易ではない.
したがって,その解離エネルギーは分光学の方法やその他の物理的方法で決められる.
ここで,解離エネルギーと解離エンタルピーの違いについて注意しておこう.
分子一つ一つを対象とする分光学や回折実験では,1個の分子の化学結合を切断するエネルギーに注目する.
したがって,体積変化にともなう仕事について考慮する必要はない.
しかし,モル単位のマクロな量の分子を標準状態で解離する場合には,エンタルピー変化として考えねばならない.
解離によるモル数の変化を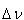 とすると,
とすると,
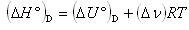 (3.13)
(3.13)
である.
温度が298.15 Kの場合,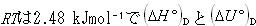 の差は結合エネルギーに比較して大きいものではない.
の差は結合エネルギーに比較して大きいものではない.
解離エンタルピーと生成エンタルピーの関係をメタンについて考えてみよう.メタンのC-H結合を一つずつ切断して行くと次のような反応が起こる.
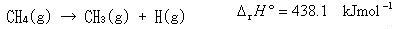 (3.14)
(3.14)
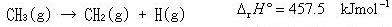 (3.15)
(3.15)
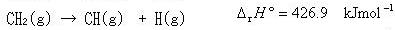 (3.16)
(3.16)
 (3.17)
(3.17)
一方,メタンの生成反応は,
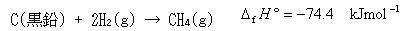 (3.18)
(3.18)
である.
ここで,反応
 (3.19)
(3.19)
 (3.20)
(3.20)
を考えると,メタンをその構成原子から生成する反応
 (3.21)
(3.21)
のエンタルピー差は,CH結合を一つずつ切断するためのエネルギーの総和となっている.
したがって,メタンのC-H結合の平均エネルギーは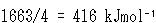 である.
である.
この値は実際にメタンからHを引き抜くエネルギーと等しくない.
すなわち,(3.14〜17)の反応の反応エンタルピーをみると,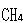 からC-H結合を切断する過程では、解離エネルギーは切断の段階毎に異なっている.
からC-H結合を切断する過程では、解離エネルギーは切断の段階毎に異なっている.
それは生成物のラジカルのエネルギー状態がそれぞれ違っているからである.
一般に,分子の特定の結合の化学結合エネルギーは,分子の種類によらず共通性をもっている.
すると,任意の化合物の生成エンタルピーは,その分子の結合の解離エネルギーがわかっていればそのおよその値を計算することができる.
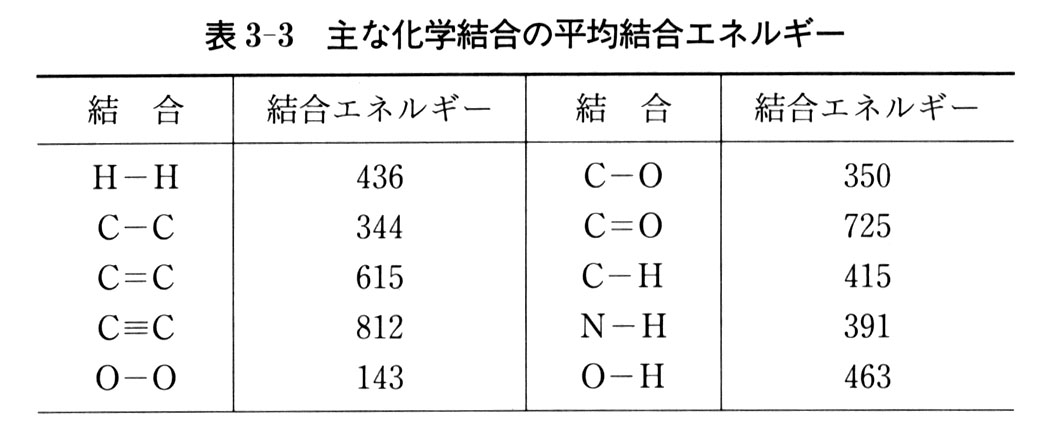
ただ,分子の各結合の解離エネルギーについて厳密には加算性が成立しないので注意する必要がある.表3-3に主な化学結合の結合エネルギーの平均値を与えておく.

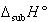
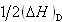
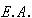
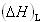
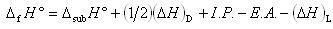 (3.12)
(3.12)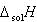 がわかっていれば,気体のイオンから水溶液中のイオンへの変化にともなうエンタルピー変化
がわかっていれば,気体のイオンから水溶液中のイオンへの変化にともなうエンタルピー変化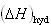 を求めることもできる.
を求めることもできる.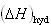 を水和エンタルピーという.表3-2に,いくつかのイオン結晶について格子エネルギーと溶解エンタルピーの値を示した.
を水和エンタルピーという.表3-2に,いくつかのイオン結晶について格子エネルギーと溶解エンタルピーの値を示した.
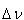 とすると,
とすると,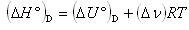 (3.13)
(3.13)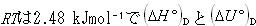 の差は結合エネルギーに比較して大きいものではない.
の差は結合エネルギーに比較して大きいものではない.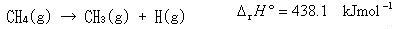 (3.14)
(3.14)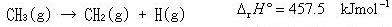 (3.15)
(3.15)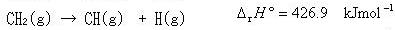 (3.16)
(3.16) (3.17)
(3.17)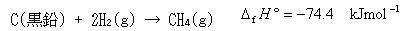 (3.18)
(3.18) (3.19)
(3.19) (3.20)
(3.20) (3.21)
(3.21)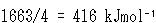 である.
である.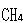 からC-H結合を切断する過程では、解離エネルギーは切断の段階毎に異なっている.
からC-H結合を切断する過程では、解離エネルギーは切断の段階毎に異なっている.