4.溶液反応の化学平衡
●溶質の化学ポテンシャル
溶液中の溶質の化学ポテンシャルは(5.20〜21)式のように定義される.
したがって,溶液中の化学平衡定数は圧平衡を求めたのと同じように定義でき,
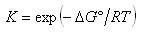 (5.35)
(5.35)
となる.
ここで,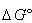 は溶液反応の標準ギブズエネルギーの差である.この関係式を中和反応に応用しよう.
は溶液反応の標準ギブズエネルギーの差である.この関係式を中和反応に応用しよう.
中和反応
 (5.36)
(5.36)
の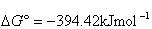 で,平衡は生成物側に非常に偏っている.
で,平衡は生成物側に非常に偏っている.
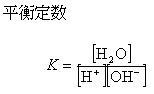 (5.37)
(5.37)
は非常に大きな値であり,[H2O] ≫ [H +][OH -]であるから
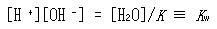 (5.38)
(5.38)
を定数と考えることができる.
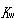 を水のイオン積という.
を水のイオン積という.
その値は,10-14mol2dm-6の桁にあるが,いろいろな温度での値を表5-1に与える.

中和反応は発熱反応であるから温度とともにKが小さくなり,イオン積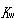 は大きくなる.
は大きくなる.
(5.38)式は水に酸や塩基などが溶けていても成立する.常温で水溶液の酸性,中性,アルカリ性は次のように定義される.
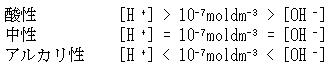
水素イオン濃度の数値の常用対数の符号を変えたものを水素イオン指数といい,pHで表す.
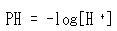 (5.39)
(5.39)
●弱電解質の電離平衡
水に溶解したときイオンに解離し,電気伝導性をもつようになる物質を電解質という.
電解質は,電離(イオン解離)の程度の大小によって強電解質と弱電解質に分類される.
強電解質に属するものは,強酸(HCl,H2SO4など),強塩基(NaOH,KOHなど)と多くの塩類(NaCl,K2SO4など)である.弱電解質に属するものは,弱酸(酢酸,硫化水素など)と弱塩基(アンモニア,アニリンなど)である.
それらの水溶液では,一部の分子だけが電離し,中性分子とイオンの間に化学平衡が成立する.
この平衡を電離平衡という.
ここで,弱酸の水溶液中での電離平衡を考えよう.弱酸をHAとすると,平衡式は
 (5.40)
(5.40)
と書ける.
いま,HAの全濃度を ,この濃度での解離度をαとすると
,この濃度での解離度をαとすると
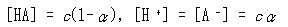
であるから(5.40)式へ代入すると,解離度の濃度依存性を表す式が得られる.
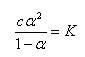 (5.41)
(5.41)
この式によれば,解離度が非常に小さい(α ≪ 1)場合,
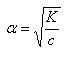 (5.42)
(5.42)
となる.
水素イオン濃度は,
 (5.43)
(5.43)
で与えられる.
いろいろな濃度の酢酸の水溶液の解離度の測定値とそれから求めた解離平衡定数の値を表5-2にまとめた.
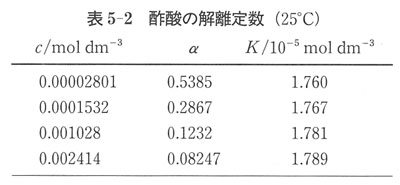
このデータによると求められた平衡定数の値が酢酸の濃度に対して一定となっていない.
それは,水溶液中のイオンを含む溶質が互いに相互作用し,独立でないためである.
より厳密には,濃度に活量係数を乗じた活量を用いて平衡定数を表す必要がある.
無限希釈の状態では,各イオンは互いに独立であるから,熱力学で定義される解離平衡が成立する.
●緩衝液
弱酸の水溶液にその塩を加えると,共通イオンの効果によって弱酸の電離は抑制される.
そのため,水素イオン濃度は小さくなる.たとえば,酢酸ナトリウムは水溶液中でほとんど完全に解離する.
CH3COONa → CH3COO - + Na +
すると,酢酸の電離平衡
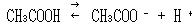
では,[CH3COO -]が大きくなるため左へ平衡が偏る.
すなわち,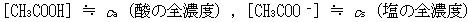 と見倣せる.
と見倣せる.
したがって,この混合水溶液中の水素イオン濃度は
 (5.44)
(5.44)
となる.
ここで,  は酢酸の電離平衡定数である.
は酢酸の電離平衡定数である.
この混合溶液に少量の酸やアルカリを加えても[H +]は変わらない.
このような溶液を緩衝液と呼ぶ.
水素イオン濃度を一定に保つ緩衝作用は,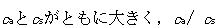 が1に近い場合に強い.
が1に近い場合に強い.
 (5.35)
(5.35) は溶液反応の標準ギブズエネルギーの差である.この関係式を中和反応に応用しよう.
は溶液反応の標準ギブズエネルギーの差である.この関係式を中和反応に応用しよう. (5.36)
(5.36) で,平衡は生成物側に非常に偏っている.
で,平衡は生成物側に非常に偏っている. (5.37)
(5.37)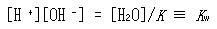 (5.38)
(5.38) を水のイオン積という.
を水のイオン積という.
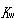 は大きくなる.
は大きくなる.
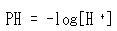 (5.39)
(5.39) (5.40)
(5.40) ,この濃度での解離度をαとすると
,この濃度での解離度をαとすると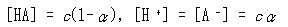
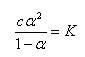 (5.41)
(5.41)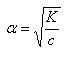 (5.42)
(5.42) (5.43)
(5.43)
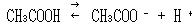
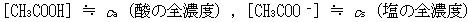 と見倣せる.
と見倣せる. (5.44)
(5.44) は酢酸の電離平衡定数である.
は酢酸の電離平衡定数である.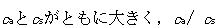 が1に近い場合に強い.
が1に近い場合に強い.