3.いくつかの物質の状態図
●水の状態図
水の状態図を図6-5に示す.
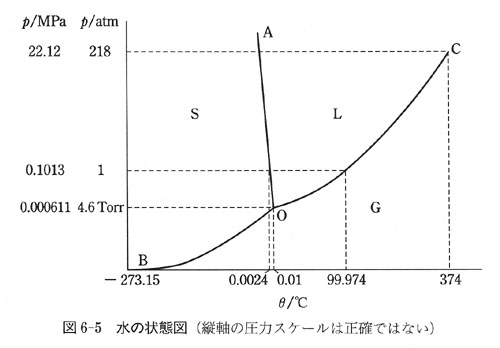
この図では,圧力の尺度を実際とは違って書いてある.
圧力の単位を厳密に記すためには,図6-6のように圧力を対数目盛としなければならない.
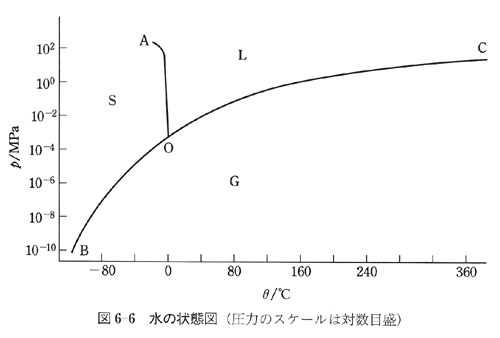
図の中で,G,L,Sと記した平面の領域では,それぞれ気相,液相,固相のみが存在する.
相の数は一つなので,領域の中では温度,圧力を自由に変えることができる.
曲線OC上では,液相と気相,OA上では固相と液相,OB上では固相と気相の二相が共存する.
ここでは自由度は1で,温度と圧力のどちらかを定めればもう一方は決まる.
曲線OCは液相の蒸気圧(一定温度で液相と気相が共存するときの圧力)の温度変化を表す.
それは後に説明する臨界点Cで終わる.
曲線OAは融点(一定圧力で固相と液相が共存するときの温度)の圧力による変化を表す.
O点では,気相・液相・固相が共存し,自由度は0で,温度も圧力も一定の値に定められる.
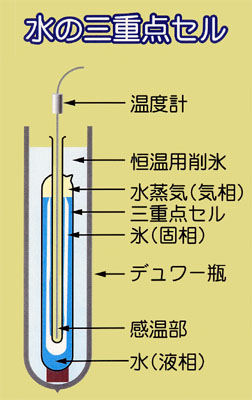
この点は,物質固有な点であり,三重点と呼ばれる.
水の三重点は,温度273.16 K(0.01℃),圧力4.58 Torr(610.6 Pa)である.
この温度は,水自体のもつ蒸気圧のもとでの凝固点,氷の融点である.
なお,三重点は絶対温度の基準として採用され,その温度の273.16 Kは定義である.
図6-5で圧力1 atmの水平線が曲線OAと交差する点は,水の凝固点である.
この温度は,図では0.0024℃と指定されていて,普通われわれが知っている氷点の0℃と異なっている.
0℃の氷点は空気の溶解した水のそれであるのに対し,ここでは空気を含まない純粋な水の氷点を指している.
次の章で説明するように空気の溶けた水の凝固点は凝固点降下のために純粋な水のそれより少し低い.
また,圧力l atmの線が蒸気圧曲線と交差する点の温度は沸点である.この温度は99.974℃と指定されている.
これは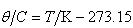 の式によってセルシウス温度を絶対温度目盛で定義し直した結果である.
の式によってセルシウス温度を絶対温度目盛で定義し直した結果である.
凝固点の圧力変化を示すのが曲線OAである.
この曲線は温度に対してほとんど垂直であるが,負の勾配を示している.それは氷が水へ相変化する際モル体積の減少が起こるからである
.
●超臨界状態
水蒸気を臨界点の温度,圧力の374℃,218 atm以上にすると液体と同じ位の密度でありながら気体の状態にある.
この状態を超臨界状態という.
超臨界状態では,圧力によって密度を大きく変えることができる.
その結果,超臨界状態の水のもつ性質が大きく変わる.
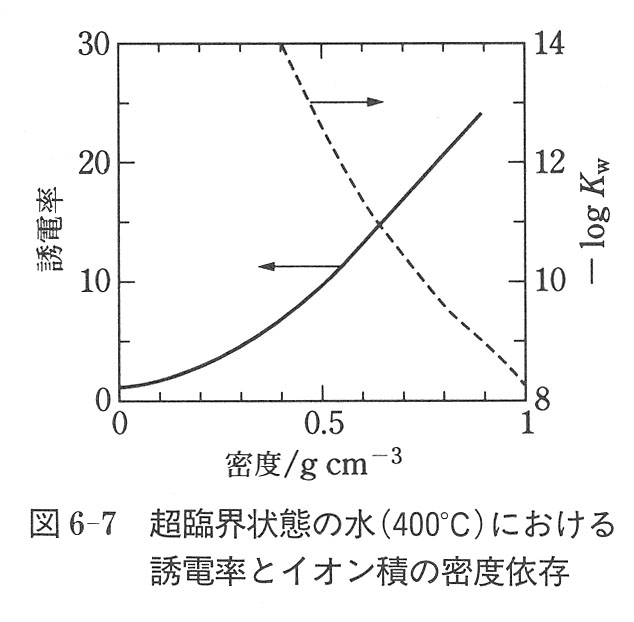
図6-7に400℃の超臨界水の誘電率とイオン積Kwの密度による変化を示した.誘電率は溶媒としてイオンを安定化する程度を表すパラメーターと考えてよい.
普通の水の誘電率は78という大きい値を示すが,超臨界状態の水の誘電率は圧力によって大きく変わる.
密度の小さい領域では,誘電率は無極性分子の溶媒のそれと類似しているが,密度が0.5gcm-3以上では極性分子の溶媒と同じである.
したがって,超臨界状態の水は,圧力を加減することによって,無極性溶媒から極性溶媒へ変化させることができる.
一方,水の水素イオンと水酸イオンの解離の程度を示すイオン積Kwは,密度の高い超臨界状態でその値は10-8にも達する.
この場合の水素イオン,水酸濃度は10-4moldm-3となり,普通の水の場合より3桁も大きい.
このことを利用して,超臨界状態の水の中で加水分解反応を効率よく起こすことなどの応用が提案されている.
●二酸化炭素の状態図
二酸化炭素の状態図を図6-8に示す.
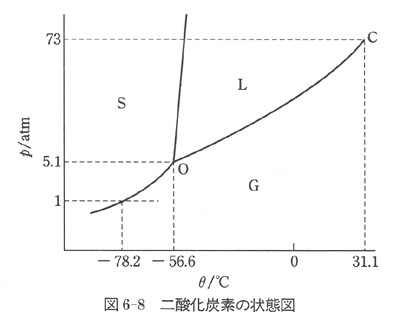
水の場合と同様に縦軸の圧力スケールを見やすくするために加減してある.二酸化炭素の三重点は-56.6℃,5.1 atmで,1 atmよりも高い.
したがって,1 atmの圧力で水平線を引くと昇華曲線と-78.2℃の所で交わる.
二酸化炭素の固体(ドライアイス)を温めると,この点で液体を経ることなく,直接気化(昇華)する.圧力5.1 atm以上では,二酸化炭素の固体は融解して液体となる.
二酸化炭素をつめたボンべの中では,液体と気体が共存して平衡にある.20℃では,気体の圧力は56.5 atmである.
二酸化炭素の固体の融解曲線は,わずかに正に傾いている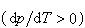 .それは,液体のモル体積が固体のそれよりわずかに大きいからである.
.それは,液体のモル体積が固体のそれよりわずかに大きいからである.
●炭素の状態図
炭素にはダイヤモンドと黒鉛(グラファイト)という異なる結晶状態がある.
この他,木炭,スス,カーボンブラックなどの明確な結晶状態を示さない無定形炭素の状態がある.
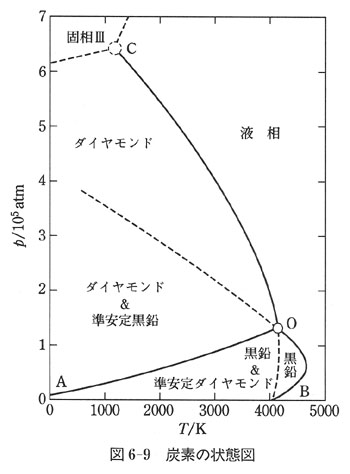
図6-9に炭素の状態図を示す.常温常圧で熱力学的に安定な相は黒鉛である.
ダイヤモンドは準安定状態であるが,黒鉛へ転移する速度は非常に小さいのでダイヤモンドが自然に黒鉛へ変わることはない.
炭素の状態図は,アメリカ合衆国のジェネラル・エレクトリック社のバンディ(F.P.Bundy)が1963年に提案したものである.
曲線OAは黒鉛とダイヤモンドの転移曲線である.
ダイヤモンドのモル体積は黒鉛のそれよりも小さいから転移によるモル体積変化は正である.
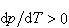 であるから転移エンタルピーは高温で正である.
であるから転移エンタルピーは高温で正である.
黒鉛・ダイヤモンド・液相の三相が共存する三重点は圧力1.23×lO5 atm,温度4100 Kの付近にある.
曲線OCはダイヤモンドの融解曲線,また,曲線OBは黒鉛の融解曲線で,これを延長した破線は,それぞれの準安定な相の融解曲線である.
なお,6×105 atm以上の圧力では,ダイヤモンドは密度のより高い金属的状態になると推定されている.
ダイヤモンドを黒鉛から合成しようという試みは,100年以上前からなされたが,実際に成功したのはジェネラル・エレクトリック社で1955年のことである.
ダイヤモンドが熱力学的な安定な温度・圧力の条件で,転移反応を加速するために金属触媒がもちいられた.



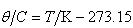 の式によってセルシウス温度を絶対温度目盛で定義し直した結果である.
の式によってセルシウス温度を絶対温度目盛で定義し直した結果である.

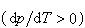 .それは,液体のモル体積が固体のそれよりわずかに大きいからである.
.それは,液体のモル体積が固体のそれよりわずかに大きいからである.
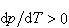 であるから転移エンタルピーは高温で正である.
であるから転移エンタルピーは高温で正である.