2.物質の段階的構成
原子核と電子が原子を生じ,原子が集まって分子をつくる。
さらに,分子が集まって液体や固体となったり,異種の分子が集まって溶液になったりする。
実在の物質は基本粒子が段階的に集まって生まれたものである。
(1)分子と分子集団
使い捨てライターの燃料であるブタンは炭素原子4個と水素原子10個が結合した分子の集まりである。
ブタンは無色で揮発しやすい液体であるが,空気中で燃えやすく,燃焼のときは炎をあげ熱を発生する。
これらの性質は何に由来するのであろうか。
液体のブタンはC4H10分子の集合体で,揮発した後もブタンである。
気体のブタンと液体ブタンとの違いは,分子の集まり方にある。
揮発しやすいが,少し温度を下げるか,封じた容器に入れて圧力をかけると液体のままでいるのは,液体になったブタンの性質であって,C4H101個ではこういう性質は考えられない。
これに対し,大気中で燃えやすい―気体の酸素と反応しやすい―性質はブタン分子そのものの性質である。
我々がある物質の性質として理解している内容をよく考えると,物質構造の色々の段階に対応して生まれた性質であることが分かる。
ブタン,ドライアイス(CO2),ブドウ糖(C6H12O6)のように,原子が化学結合して分子を与え,分子が集まって液体・固体になるという2段階が区別できる物質を分子性物質(またはディスクリートな物質)と呼ぶ。
(2)固体物質
銅・鉄などの金属や,塩・水晶などの結晶では,液体ブタンなどと違って,途中に分子という中間段階は存在しない。
金属銅は多数の銅原子が集まってできたもので,銅原子が3個,10個などと一定数集まった中間的な構成単位は見られない。
高温にして揮発させれば,Cuの単原子となる。
ナトリウム陽イオンと塩化物陰イオンからなる食塩の結晶でも同様である。
(ただし,高温で揮発させた塩化ナトリウムの蒸気はNaClという分子からなる。)
ケイ素原子と酸素原子からなる水晶においても,中間がなくて,原子が結合して直接固体物質をつくっている。
このように金属,イオン結晶などの固体は分子性物質とは著しく異なる。
分子レベルと分子集団レベルを区別出来ない物質を固体物質という。
固体結晶でもドライアイスのように,分子からなる固体(分子結晶)は固体物とはいわない。
このような観点で物質を整理すると表1-1のようになる。
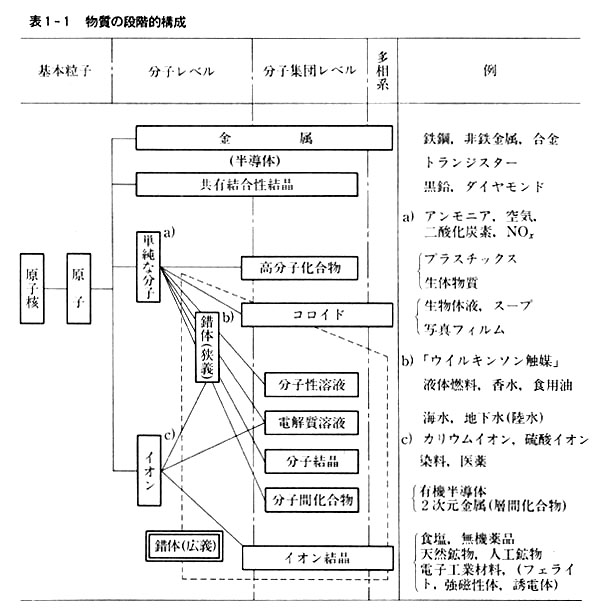
物質の中にはこの分類からはみ出るものもあるが,物質の性質を理解するのに便利である。
色々の性質が物質構成のどの段階で現れるかを整理したのが表1-2である。


