第10章 金属からイオンへ
金属は各種の溶液と反応して陽イオンとなり,溶液中では水分子と結合して水和イオン等として存在する。
今回は金属からイオンへの変化しやすさについて定量的に考察する.
この過程は電気分解・電池などの現象として観察され,化学反応に伴う自由エネルギーの変化と結び付けられ,また金属の製錬工程や錆の生成とも関連深い。
一方金属イオンから溶液中でどのような分子や陰イオンと結合しやすいかは金属元素の特性を反映している.
1.金属のイオン化
(1)イオン化傾向
銅塩の水溶液に亜鉛片を浸すと,銅の一部が金属となって亜鉛の上に析出し,亜鉛の一部は亜鉛イオンとなって溶けてゆく.
しかし亜鉛塩溶液に銅片を浸しても変化はみられない.
次式の反応は右へ進むが左へは進まない.
Cu2++Zn→Cu+Zn2+ (lO.1)
2種の金属元素について上記のように観察すると,金属→金属イオンの変化を生じやすい順に金属元素を並べることができる.
これが金属のイオン化系列と呼ばれる順序で主な元素では次のとおりである.
K-Na-Ca-Mg-Zn-Fe-Ni-Sn-Pb-(H)-Cu-Hg-Ag-Pt-Au (10.2)
順列上で左の元素は右の元素よりイオン化しやすく,右元素イオンの溶液に左元素の単体金属を接触させると(10.1)のようなイオンの交換が起こる.
他の反応でも左の元素ほどイオンになる反応を起こしやすい.
例えば水との反応ではK,Na,Caは冷水とでも式(10.3)のように反応するが,
Ca+2H20→H2+Ca(OH)2 (10.3)
Znと鉄Feでは熱水とだけ同様に反応する.
また鉛Pbまでは金属の錆びていない面は塩酸などに溶けるが,下段の元素は硝酸のような酸化力のある酸にだけ溶ける.
2Ag+4HNO3-→2AgNO3+2H20+2NO2 (10.4)
PtとAuは酸化力の強い塩酸と硝酸の混合物(王水)にしか溶けない.
3HCl+HNO3→NOCl+Cl2+2H2O (10.5)、
(以上のことは高校で学んだ.)
(2)可逆電池
金属のイオン化傾向を利用して化学反応のエネルギーを電流に変える装置が電池である.
電池のうち電流を流す方向を逆にすると,化学反応も逆方向に進行するものを可逆電池という.
鉛蓄電池やグニエル電池がその例である.
19世紀の初め,英国のダニエルは次のような組み合わせを持つ電池を作った.
Cu板│ CuSO4水溶液 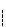 ZnSO4水溶液│ Zn板 (10.6)
ZnSO4水溶液│ Zn板 (10.6)
硫酸鋼溶液と硫酸亜鉛溶液(これらを電解液という)は混合しないように素焼板で仕切る.(図10-1)
こうすると銅が陽極,亜鉛が陰極となって電流が流れる。
ダニエル電池の起電力Eは硫酸銅と硫酸亜鉛溶液の濃度および温度に依存する。
両溶液の濃度がl mol dm-3の時,1.10Vである。
この電位差は銅の側に0.337V,亜鉛の側に0.763V帰属される。
また硫酸銅,硫酸亜鉛の濃度を[CuSO4],[ZnSO4]で,絶対温度をTで示すと,式(lO.7)のように一般化される*注
(Fはファラデー定数,nは授受される電子数,Rは気体定数).
E=1.10+(RT/nF)log10([CuSO4]/[ZnZO4])
(ネルンス卜の式) (10.7)
この式は熱力学的に極めて重要な意味を持つので,内容をさらに検討する.
*注 [濃度と活量]
ここで濃度と表現したのは正確でなく,活量または活動度というべきものである.
溶質の活量はモル濃度に一定の係数(活量係数)を掛けた値で,熱力学的な意味を持ち,理想気体,理想溶液においてはモル濃度に等しい(活量係数は1).
実在溶液を熱力学的に扱うには便利な概念である.
活量係数は多くの場合1より小さい.
粗い近似としては,実在溶液中ではイオンなどの溶質が完全に自由ではなく,他の溶質または溶媒分子との相互作用によって束縛されており,あたかも濃度が低いかのような行動を示すためと解釈できる.
[液間電位]
電解質の種類や濃度の異なる溶液が接蝕すると電位差を生じる。
両液相中のイオンが接触界面を通って拡散する速度に差があるのが原因で,水溶液では数十mV以下であるが,精度の高い測定では無視できない.
この影響を避けるためには,陽イオンと陰イオンの易動度のほぼ等しい塩化カリウム,硝酸カリウム,硝酸アンモニウムなどの比較的濃い溶液で2液層目を連結する.
これを塩橋という.
液が混合しないよう,逆U字管に塩橋用の溶液を寒天で固めたものを入れたり,半融ガラス板を末端につけて塩橋用溶液を入れることが多い
(3)標準電極電位
可逆電池の電位差を考えるには,二つの電極を別個のものとして考察するのがよい.
電池は正極(陽極)と負極(陰極)と組み合わせて始めて動作するものであり,一方の電極だけでは働かないが,便宜上このように考える.
これを半電池という.
ダニエル電池においては次の二つの半電池が組み合わされたと考えることができる.
Cu │ CuSO4 および Zn │ ZnSO4
平衡状態にある半電池の起電力E(平衝電極電位という)は,次式で示されるが,これもネルンストの式と呼ぶ.
E=Eo+(RT/nF)loge(ao/ar) (10.8)
ここでR,T,nFは式(10.7)と同じで,aoとarは酸化されたもの(通常はイオン)および還元されたもの(通常は金属)の活量を示す.
純金属を電極とし,電解液の濃度(正確には活量)を1とした時(第2項は0)のE値をEoとし,これを標準電極電位という.
このような半電池を組み合わせた電池の起電力は陽極側のEo値から陰極側のEr値を引いたものとなる.
濃度1Mの電解液を用いたダニエル電池については,
0.337V-(-0.763V)=1.10Vとなった.
半電池については平衡電極電位も標準電極電位も直接測定できないから,一つの半電池を基準としてその電位を0と定め,それと組み合わせた可逆電池の電位として表示する.
基準に用いる半電池を基準電極(または参照電極,照合電極)と呼ぶ.
通常は水素電極を基準とする.
これは次のような半電池であるが,気体水素を電極にするため,表面を大きくした白金板(白金黒)に吸着させて用いる.
│Pt│H2(1atm)│ H+(a=1) (10.9)
例えば亜鉛の標準電極電位は次の可逆電池の起電力として測定される(25℃で-0.735V).(図10-2)
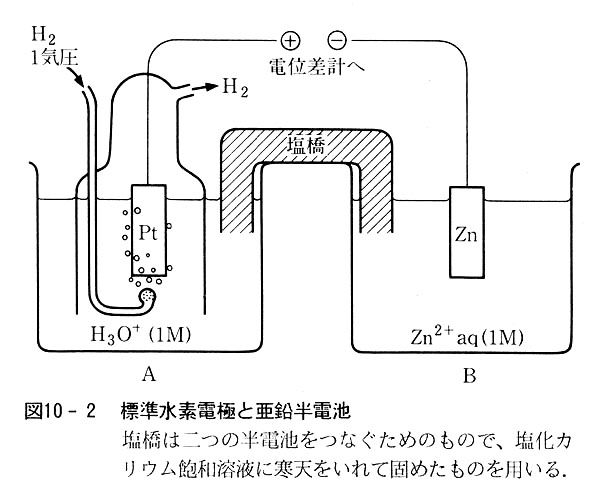
│Pt│H2(1atm)│ H+(a=1)∥Zn2+(a=1)│Zn (10.10)
こうして得た値はVvs.NHEとして表示する.
特に指定せずに標準電極電位という時はこの値である.
基準水素電極は実際の取扱いが不便なので,実用上は扱いやすい
飽和カロメル電極を用いる.
Hg│Hg2Cl2(ペースト)│KCI(飽和水溶液)∥この電極は25℃で
O.2412Vvs.NHEの電位を持ち,これを基準電極とした値Vvs.SCEを実測し,Vvs.NHEに換算して表示するのが便利である.
表10-1にはおもな金属の標準電極電位を示した。

ハイフンでつないだ左側のイオンが電子と結合して,右側の金属になる時の電位として表示してある.
この値が負になるほど金属はイオン化しやすい.
式(1O.1)でみた順番は,この値を小さいほうから順に並べたものとほぼ一致する.
つまり式(10.1)は標準電極電位の順を表している.
(4)電気分解
電池の場合は電極における化学変化で生み出されるエネルギーが電流として取り出せるが,これと逆に電流の形でエネルギーを与え,化学変化を起こさせることもできる.
これが電気分解または略して電解と呼ばれる現象である.
例えば硫酸銅(Ⅱ)水溶液に銅板の陽極と陰極を浸して電流を通じると,陽極から銅(Ⅱ)イオンが溶け出し,陰極には金属銅が析出する.
溶液中の銅イオン濃度は変化しない.この時は次の反応が起こっている.
陽極 Cu→Cu2++2e-
陰極 Cu2++ 2e-→Cu
(陽極に黒鉛板を用いれば陰極では同様の反応が起こり,溶液中の銅イオン濃度は減少してゆく.)
この反応は銅を精製する時に用いられる.
粗銅厚板を陽極に,純銅薄板を陰極とし,一定の電流を流す.
電極にかける電位差をうまく選ぶと,陽極からは銅およびそれよりイオン化しやすい元素だけが溶け出し,(金・銀などは微粉となって容器の底にたまる)陰極では銅イオンだけが還元されて金属銅となり,それより電極電位の低い池の金属イオン(亜鉛,鉄など)は還元されないようにすることができる.
こうして粗銅を純銅に変えるが,生じた純銅を電気銅と呼ぶ.
 ZnSO4水溶液│ Zn板 (10.6)
ZnSO4水溶液│ Zn板 (10.6)

