第11章 金属錯体
水和イオンのように,金属イオン(中心イオン)の周りに分子や陰イオンが規則正しく並んだものを錯休と呼ぶ.
周りに並ぶイオンや分子を配位子,中心イオンの最も近くに位置する配位子の原子を配位原子という.
錯体は昔は複雑な特殊化合物とみられていたが,今日では化合物の基本的な姿を代表し,基礎研究にとって重要なだけでなく,工業的にも,また生体機能を理解する上でも大切な物質群であると理解されている.
この科目でも本回以後の各回は錯体と関係が深い.
1.溶液中での金属イオン
水に溶けた塩類の正負イオンは水分子が周りに結合した水和イオンとして存在することは前回学んだ.
こういう水溶液に他のイオンや分子を加えると,水分子との入れ替わりが起こることがある.
(1)配位子置換反応
塩化コバルト(Ⅱ)の無水塩は青色であるが、水に溶けるとピンク色になる。
これは[Co(H2O)6]2+のような水和イオンを生じたためである.
これに塩酸を加えてゆくと,赤紫色から青紫色を経て塩酸濃度5Mになると青色になる.
これは次の平衡が順次ずれてゆき,最後には青い[CoCl4]2-を生成したためである.
2価コバルトイオンの周りでは配位数が6から4に変化している.
(図11-1)

[Co(H2O)6]2++Cl- 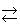 [CoCl(H2O)5]++H2O
[CoCl(H2O)5]++H2O
(11.1)
[CoCl(H2O)5]++Cl- 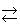 [CuCl2(H2O)4]+H2O
[CuCl2(H2O)4]+H2O
(11.2)
[CoCl3(H2O)]- + Cl- 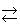 [CoCl4]2- + H2O
[CoCl4]2- + H2O
(11.3)
まとめて書けば式(11.4)のようになる.
[Co(H2O)6]2++4Cl- 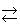 [CoCl4]2-+6H2O
[CoCl4]2-+6H2O
(11.4)
このように配位子が入れ替わる化学変化は配位子置換反応と呼ぶが,化学平衡として扱うことができる.
上例のように反応が順にⅠ段ずつ化学平衡として進行して行く場合は逐次平衡と名付ける.
コバル卜(Ⅱ)イオンと塩化物イオンの濃度に応じて種々の異なる錯体が混合物として存在するのである。
このほかのハロゲン化物イオン,無機オキソ酸イオン,有機カルボン酸イオン,有機アミン類,アルコール類,チオアルコールRSHやそのイオンRS-,チオエーテル類RSR′,シアン化物イオンCN-,チオシアン酸イオンNCS-なども多くの金属イオンと安定な錯体を作る配位子となる.
(2)錯体の安定度
コバルト(Ⅱ)イオン周りの配位子置換反応は速いので,式(11.1)~(11.3)の化学平衡は速やかに成立する.
左辺の状態と右辺の状態のどちらが安定かは平衡定数を用いて比較することができる.
例えば式(11.1)では,(電価は省略)
K1=[CoCl(H2O)5][H2O]/[Co(H2O)6][Cl-] (11.5)
のように示される.
このKは無次元の量であるが,温度と圧力に依存することはいうまでもない.
希薄溶液の場合は,右向き反応の結果生じる水の量は溶媒として存在する水(55.5M)にくらべ無視できる.
それ故反応後でも,水の量は一定に保たれるとして,式(11.5)を(11.6)の形で書くこともある.
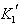 =[Co(H2O)5]/[Co(H2O)6][Cl] (11.6)
=[Co(H2O)5]/[Co(H2O)6][Cl] (11.6)
K´は濃度の逆数(dm3mol-1)という次元をもち,
K=55.5moldm-3×K´
の関係が成立する.
データブックにはK´が多く掲載される.
KまたはK´を逐次平衡定数と言う.
これに対し,式(ll.4)に対応する平衡定数は
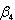 =[CoCl4][H20]6/[Co(H20)6][Cl]4 および
=[CoCl4][H20]6/[Co(H20)6][Cl]4 および
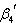 =[CoCl4]/[Co(H20)6][Cl]4 (11.7)
=[CoCl4]/[Co(H20)6][Cl]4 (11.7)
と示され, 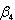 および
および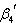 を(第4段までの)全平衡定数という.
を(第4段までの)全平衡定数という.
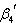 はdm12mol-4(M-4,Mはモル濃度)という次元をもつ.
はdm12mol-4(M-4,Mはモル濃度)という次元をもつ.
第何段までの置換反応までを考えたかによって単位が異なるので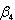 や
や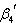 を比較する場合は注意しなくてはならない.
を比較する場合は注意しなくてはならない.
(3)安定度定数の測定
錯体の配位子置換反応に関わるK値やβ値は単に化学平衡に関するデー夕として重要なだけでなく.反応に伴う熱の出入り,反応速度および逆反応の速度,さらに錯体の触媒作用を理解する基礎としても役立つ.
測定方法としては電気化学的方法,分光学的方法,熱測定法などが重要であり,また,pH滴定法、放射性トレーサー法,nmr法なども用いられる.
ここでは代表的な分光法と熱滴定法を説明し,装置を映像によってみることにする.
どの方法を用いる場合でも,測定時の温度とイオン強度を一定に保つことが不可欠である.
a) 分光法
錯体には着色したものが多いので,ある波長の光を吸収する度合を丁寧に測定すれば,平衡定数を求められる(式11.13).
式(11.1)の化学平衡において[Co(H2O)6]2+および[CoCl(H2O)5]+をA,Bと略記し,A及びBの濃度がa,b,ある波長におけるモル吸光度が ,
, 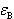 であるとする.
であるとする.
溶液中のコバル卜及び塩化物イオンの全濃度を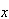 ,
,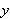 とすると,式(11.6)は式(11.8)のように書ける.(Cl-のεは0である)
とすると,式(11.6)は式(11.8)のように書ける.(Cl-のεは0である)
K´=b/a(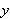 -b),ただしa=
-b),ただしa=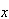 -bだから,
-bだから,
K´=b/(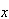 -b)(
-b)(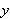 -b) (11.8)
-b) (11.8)
また溶液の吸光度測定値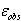 は
は
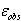 =
= a+
a+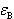 bと表現される. (11.9)
bと表現される. (11.9)
ここで未知数はK´とa,bだから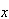 ,
,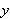 を最低2種類変えて
を最低2種類変えて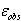 を測定すれば,連立方程式を解いてK´を求めることができる.
を測定すれば,連立方程式を解いてK´を求めることができる.
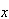 ,
,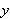 を種々に変えた測定を行えば,最小自乗法によって精度の高いK´が求められる.
を種々に変えた測定を行えば,最小自乗法によって精度の高いK´が求められる.
b) 熱測定法
カドミウムイオンを例にとって水分子の代わりに塩化物イオンが配位する反応をみよう.
[Cd(H2O)6]2++Cl- 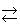 [CdCl(H2O)5]++H2O
[CdCl(H2O)5]++H2O
(11.10)
塩化物イオン濃度を高くすると式(11.10)の平衡が右のほうにずれてゆき,さらに順に水分子が塩化物イオンと入れ替わって,最終的には式(11.11)のようにCd2+にCl-、4個の結合した錯陰イオンを与える.
[CdCl3(H2O)]2-+Cl- 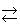 [CdCl4]2-+H2O
[CdCl4]2-+H2O
(11.11)
この化学変化は1段ずつ進行してゆくが,カドミウムイオンの配位数は途中で6から4に変わる.
こういう化学変化を調べるためには,カドミウムイオンが無色のため分光法は応用できず,化学変化に伴って放出または吸収される熱を測定するのがよい(カロリメトリー).
種々の濃度の過塩素酸カドミウム水溶液に塩化カリウム水溶液を少しずつ加え,その度ごとに溶液の温度を精密に測定し,「熱滴定曲線」(図11-2)を画かせ,その結果を解析する.
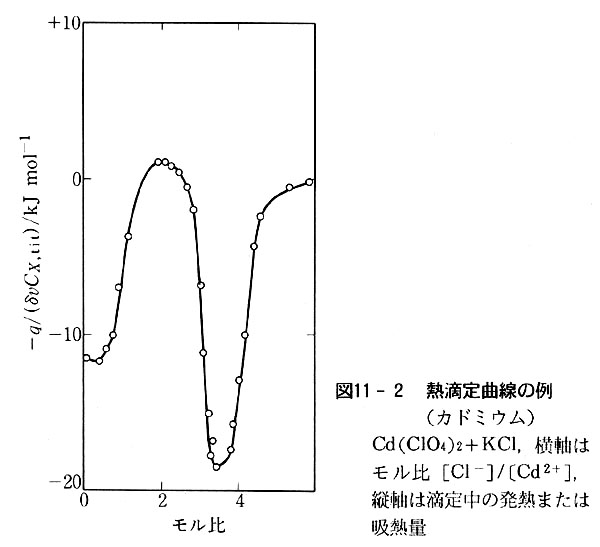
このような方法を「熱量滴定」という.
図11-3には,塩化物イオンの濃度を変えた時,0~4個のCl-がついた錯体がどのような割合で存在するかを示している.
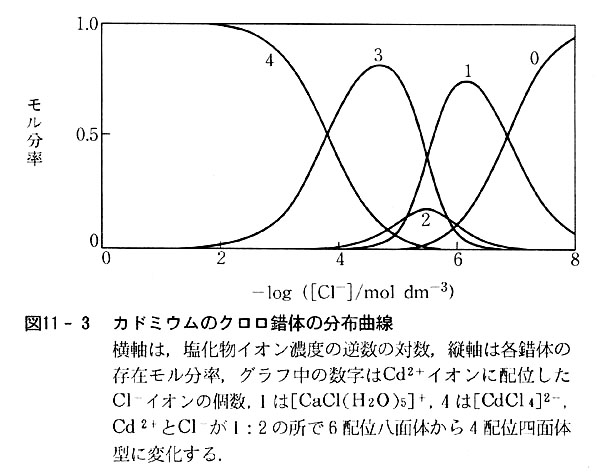
[CdCl2(H2O)4]の存在する領城の狭いことが分かる.
また反応熱のデー夕から,塩化物イオン2以上の錯体は4配位になっていることも推定される.(映像参照)
(4)置換反応の速度
配位子の置換する速度は速いものも遅いものもある.
置換速度が大きい場合にはp.164に述べたように化学平衡が速やかに成立するが,そのような錯体を置換活性錯体という.
化学分析に用いられるようなものはすべてこの種類のものである.
一方3価コバルトイオン,3価クロムイオン,白金族元素の錯体などは置換反応が遅く,置換不活性錯体と呼ぶ.
これらは平衡に到達するまでに多くの時間を要し,平衡定数を考える事はできない.
置換活性の度合を知るためには図9-7(p.146)に示した配位水分子の交換速度が目安となる.
置換反応の速度を求める方法は各種あるが,便利で多用されるのは分光光度法である.
これは吸収スペクトルの時間変化を観測する方法で,通常は適当な波長を選び,その吸光度の時間変化を測定し,解析する.(図11-4)
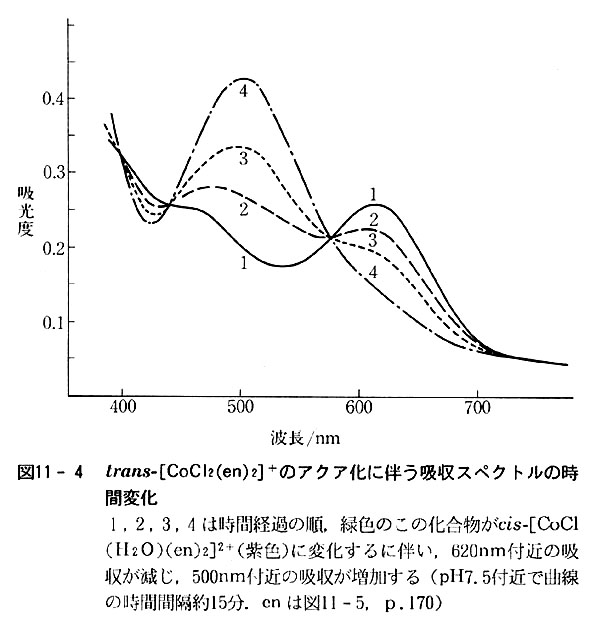
また1分以下で完了する速い反応の速度を追跡するためには,ポ-ラログラ法や,ストップドフロ-法,nmr法などの緩和法が用いられる.
(5)安定度を支配する因子
錯体の安定度は中心イオンおよび配位子の性質によるほか,両者の組み合わせにも依存する.
a) 中心イオン側の条件
同一の配位子に対して
(i)イオン価の高いほど,(ⅱ)同じイオン価ならばイオン半径の小さいほど安定度は大きい.
(ⅲ)第4周期の2価遷移元素イオンに対してはアーヴィング・ウイリアムス系列(11.12)が成立する.
Mn<Fe<Co<Ni<Cu<Zn (11.12)
(ⅰ),(ⅱ)は静電的な結合力を考えると説明できる。
(ⅲ)はd軌道の分裂に基づく安定化の影響である.
b) 配位子側の条件
同一の中心イオンに対しては,
(i)配位子の塩基性の大きいものが安定度が大となる.
塩基性の尺度としては,配位子の共役酸のpKが用いられ,その値の大きい程塩基性は大きい.(p.69参照)
(ⅱ)類似のpK値をもつ場合はキレート(p.171)を形成する場合に大きい安定度をもつ.
(i)は配位結合がルイス酸塩基結合であることから容易に理解できる.(p.69)
(ⅱ)は2座以上の配位子が配位することで,2分子以上の水和水分子が脱離し,自由度が増すためのエン卜ロピ-増加による効果が原因である.
C) 組み合わせの問題
ルイス酸塩基の硬いか軟らかいかによって,硬い同士の組み合わせ,及び軟らかい同士の組み合わせは安定度の大きい錯体を与えやすい.
(HSAB原理p.159参照)

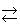 [CoCl(H2O)5]++H2O
[CoCl(H2O)5]++H2O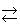 [CuCl2(H2O)4]+H2O
[CuCl2(H2O)4]+H2O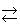 [CoCl4]2- + H2O
[CoCl4]2- + H2O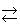 [CoCl4]2-+6H2O
[CoCl4]2-+6H2O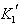 =[Co(H2O)5]/[Co(H2O)6][Cl] (11.6)
=[Co(H2O)5]/[Co(H2O)6][Cl] (11.6)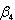 =[CoCl4][H20]6/[Co(H20)6][Cl]4 および
=[CoCl4][H20]6/[Co(H20)6][Cl]4 および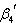 =[CoCl4]/[Co(H20)6][Cl]4 (11.7)
=[CoCl4]/[Co(H20)6][Cl]4 (11.7)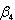 および
および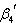 を(第4段までの)全平衡定数という.
を(第4段までの)全平衡定数という.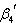 はdm12mol-4(M-4,Mはモル濃度)という次元をもつ.
はdm12mol-4(M-4,Mはモル濃度)という次元をもつ.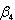 や
や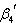 を比較する場合は注意しなくてはならない.
を比較する場合は注意しなくてはならない. ,
, 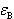 であるとする.
であるとする.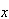 ,
,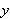 とすると,式(11.6)は式(11.8)のように書ける.(Cl-のεは0である)
とすると,式(11.6)は式(11.8)のように書ける.(Cl-のεは0である)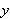 -b),ただしa=
-b),ただしa=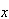 -bだから,
-bだから,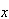 -b)(
-b)(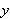 -b) (11.8)
-b) (11.8)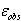 は
は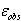 =
= a+
a+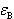 bと表現される. (11.9)
bと表現される. (11.9)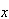 ,
,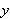 を最低2種類変えて
を最低2種類変えて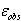 を測定すれば,連立方程式を解いてK´を求めることができる.
を測定すれば,連立方程式を解いてK´を求めることができる.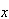 ,
,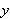 を種々に変えた測定を行えば,最小自乗法によって精度の高いK´が求められる.
を種々に変えた測定を行えば,最小自乗法によって精度の高いK´が求められる. [CdCl(H2O)5]++H2O
[CdCl(H2O)5]++H2O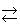 [CdCl4]2-+H2O
[CdCl4]2-+H2O

