2.金属イオンの保持と運搬
(1)鉄の存在と移動
鉄は生命に不可欠の元素であるが,人体の鉄含有量は質量にして0.01%に満たない.
その約70%は血色素中のへモグロビンとして存在し,20~25%はフェリチンという夕ン白質と結合して貯蔵され,残りは不溶性のヘモジデリンという穎粒中に含まれる.
フェリチンは文字どおり鉄の貯蔵庫で,ヘモグロビンを作るのに必要な原料鉄を保持している.
肝臓・脾臓などに存在する分子量約900,000の夕ン白質で,1分子当り数干(2000とも4500ともいわれる)の8価鉄イオンを含む.
鉄イオンの存在状態はよく分からないが,多分水和した酸化物の形でペプチド鎖の間に強く保持されているらしい.
この鉄イオンはフェリレダクターゼという酵素の作用で2価イオンに還元されてタン白質から離れるものと思われる.
遊離された鉄イオンは血漿中にO.4%ほど含まれる卜ランスフェリンという分子量80,000程度の夕ン白質に結合して血液と共に体内を動き,必要な部位に運ばれる.
トランスフェリン中で,3価鉄イオンは図12-2のように,ヒスチジンのイミダゾール環窒素原子,チロシンのフェノール酸素原子,アスパラギン酸のカルボン酸イオンの酸素原子および炭酸水素イオンの酸素原子を配位原子として持つ錯体になっている.
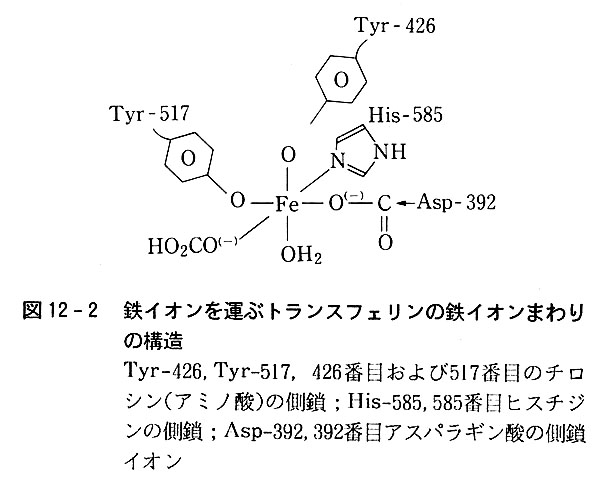
この結合は強固であるが,pH5程度の弱酸性になると鉄(Ⅲ)イオンは遊離されるし,また鉄(Ⅱ)イオンに還元されれば結合が切れやすくなる.
ヘモグロビンに渡される時は2価鉄イオンの形であろうと思われる.
つまり,トランスフェリンはフェリチンからへモグロビンに鉄を受け渡ししていることになるが,その時,鉄イオンのイオン価が変化して錯体の安定度を変え,アミノ酸の官能基と結合させたり,遊離させたりの調節を行っているわけである.
人体をはじめとする動物体では分子量の大きい夕ン白質が鉄イオンの貯蔵・運搬に関与しているが,植物や微生物ではもっと簡単な分子が鉄の貯蔵・運搬にあずかっていることが最近明らかになった.
それは、ムギネ酸と呼ばれる図12-3のような分子で,イネ科植物に含まれる分子量320の一種のアミノ酸である.
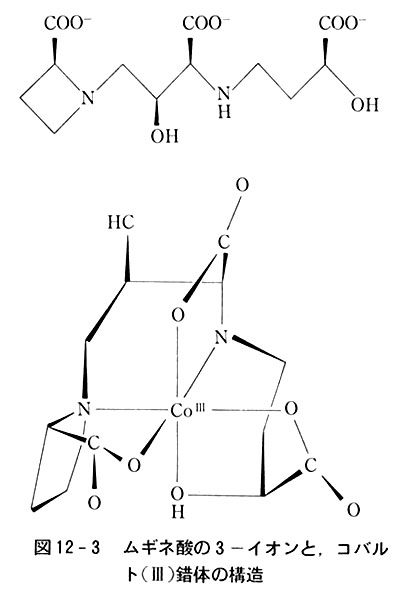
この配位子の鉄錯体の構造は明らかにされていない.
コバルト(Ⅲ)錯体は図のような構造を持ち,2個の窒素原子と両端のカルボキシラトイオンの酸素原子が平面上に,中央の-COO-と末端の-OHの酸素原子が上下軸方向に配位した6座配位子としてCo3+イオンを包み込んでいる.
多分鉄もこのような錯体を作っており,その形で膜を通過して生体内に取り込まれ,細胞内に入り,体内では2価に還元されて生体に必要な含鉄酵素などの合成に利用されるのであろう.
(2)銅の運搬
銅もまた生体に重要な元素であるが必要量は少なく,通常は十分な量を摂取しやすいので体内での貯蔵はあまり問題とならない.
多くの動物体内での運搬及び排出に関与するのは,血清アルブミンという分子量68,000のタン白質である.
これは金属イオン以外の生体物質の運搬にも寄与するが,その機構はかなり明らかにされている.
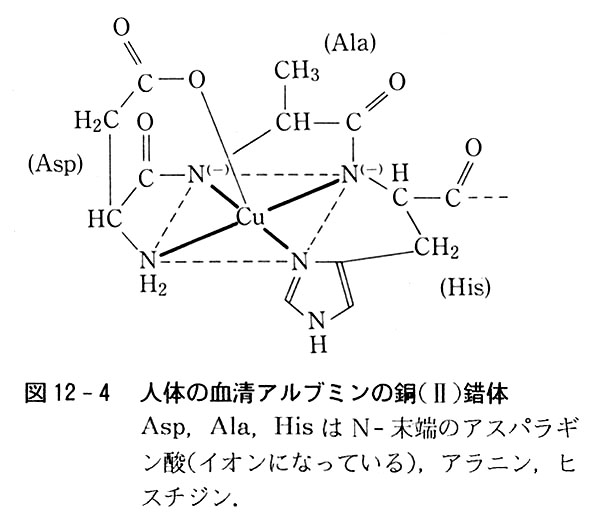
例えば人体の血清アルブミンではN-末端に,アスパラギン酸-アラニン-ヒスチジンというアミノ酸配列を持ち,(図12-4)4個の窒素原子が2価銅イオンに配位し,血流中で銅を運搬していると考えられている.
(犬の血清アルブミンでは8番目のヒスチジンの代わりにチロシンが含まれている.犬が銅の代謝をうまく行えないのはアミノ酸配列のこの差によるともいわれる.)