2.低原子価錯体
(1)低原子価を安定させる配位子
13.1に示した各種化合物は独特の構造をもつだけでなく,化学結合にも異常が多い.
その化学式には次の共通点がみられる.
a. 中心金属原子は遷移元素が多く,イオン価が低い.
b. 配位子は表13-2に示すような独特のものが多く,酸素・窒素などを配位原子とする配位子は少ない.

表示の配位子は電気的に中性で双極子モーメント(p.36)の小さいものが大部分で無極性のものもある.
これらの錯体では後に述べる独特の中心原子一配位子間の結合が存在し,単にルイス酸一塩基関係(p.69)では理解できない.
そのため「低原子価錯体」,または「非ウェルナー型錯体」と名付け,特に金属原子−炭素原子間の結合をもつものは「有機金属錯体」という.
自然界にほとんど類例の無い特殊な物質で,錯体触媒・人工酵素等としての機能が注目を集め,研究も活発で化学の重要な新分野に発展しつつある.
(2)配位結合での二重結合
酸素・窒素などの無極性分子やCOのような極性の低い分子が,中性の原子と結合しても強い静電力の寄与は期待できない.
生成熱から叶算すると,[Ni(CO)4]のNi-CO結合のエネルギーは132kJmol-1にも及ぶ.
(Al3+イオンの水和エネルギー88kJmo1-1)
低原子価錯体では,ルイス酸・塩基関係の他に別の強い結合力を考える必要がある.
図13-2は6配位正八面体型低原子価錯体での結合を摸式的に示す.
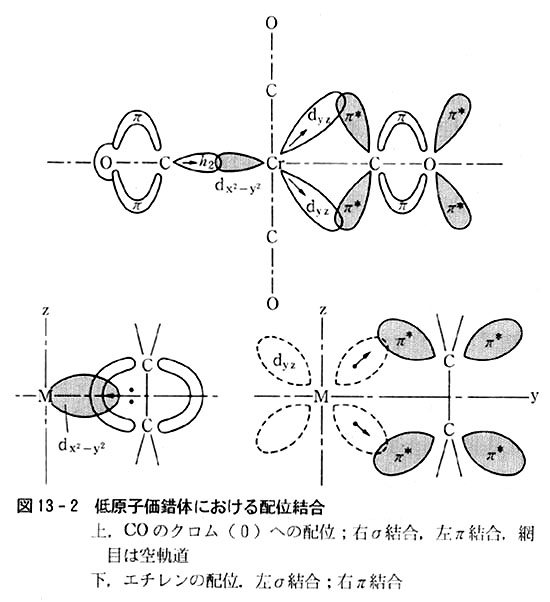
COのC原子上の非結合電子対(p.37)がクロム原子に供与されて通常のルイス酸・塩基型α結合を生じ,その上クロム(0)(d6電子配置)の3本の非結合dε軌道の電子6個が,方向の一致するCOのπ反結合軌道に供与されて,Cr-CO間にπ結合を生じている.
つまりCr-CO問には二重桔合が存在し安定化している.
エチレンを配位子とする平面四角形ツァイゼ塩では,C-Cのπ結合軌道の電子対がPt2+に供与されて(空のdx2−y2軌道との間に分子軌道を考える),α結合を作り,Pt2+のdxz軌道とC-Cのπ反結合軌道との間に配位π結合が生まれている.(p.48,図3-2参照)
配位π結合では中心原子がルイス塩基の役割を示して電子対供与体となり,配位子がルイス酸として電子対受容体となっている.
これは配位α結合における通常のルイス酸・塩基関係(p.69)とは逆の関係になるから,配位π結合のことを「逆配位」と呼ぶこともある.
逆配位が生じるためには,中心原子と配位子が分子軌道形成条件に合致する軌道をそれぞれにもち,中心原子側軌道には電子対があり,配位子側のは空であることが必要条件となる.
表13-2の配位子はこのような受入れ軌道をもつ.
中心原子の正電荷が低いほど電子を失いやすく,逆配位に有利である.
低原子価錯体では通常の配位結合の他に,逆配位結合が加わって安定化している.
(3)低原子価錯体の特性
低原子価錯体は他の化合物にはみられない特色をもつ.
その代表例を実験の映像でみよう.
a. フェロセン
熱安定性: 多くの有機化合物と違い昇華が可能.(融点178,沸点249℃)
酸への安定性:濃硫酸でも分解せず,H+が付加.
酸化還元: 造変化せずに電子移動反応を起こして鉄のイオン価が変化する.この酸化還元電位は溶媒を変えてもほとんど変化しない.
b. ビス(ビフェニル)クロム(0)
電気化学的に酸化されるが,構造は変化しない.
c. モリブデンの複核錯体[Mo2(C2H5)2(CO)6]
Mo−Mo結合をもつが,COもC5H5も置換されにくい.
しかし光にあうとMo−Moが切れ,また配位子も簡単に置換される.
これらの性質は有機化合物とも,金属錯体とも異なる、きわめて特色ある化学的性質で,無機化合物と有機化合物の中間に位置するような化合物と考えられ,どちらとも似ない独特なものであることが指摘できる.

