3.錯体触媒
(1)触媒作用の種類
化学反応速度を変化させる触媒の作用については別の科目で詳しく学ぶ機会がある.
触媒を大別すると,反応する物質(基質)と触媒が同一相に存在する「均一相触媒」と,別の相に存在する「不均一相触媒(異相触媒)」に分類される.
エステルの加水分解が酸によって促進されるのは前者の例で,ニッケルの微粉末を用いて不飽和炭化水素に水素付加反応を起こさせるのは後者の例である.
工業的な目的には不均一相触媒が広く用いられてきたが,その作用機構は不明な点が多い.
固体表面に吸着された気体分子が励起されて,反応しやすくなるといわれるが,励起分子の電子状態はあまり明らかにされていない.
均一相触媒については反応機構の研究が盛んで,反応活性種や反応中間体がかなり解明されている.
しかし実用面からみると,反応生成物を触媒や他の夾雑物から分離するのに困難も多く,必ずしも優れてはいない.
(2)錯体触謀の作用
金属錯体を均一相触媒として用いる有機化合物の合成は1950年代から急速に発展した.
代表例はポリエチレン合成に使われるチーグラ--ナッタ触媒である.
これはごく少量で非常に多量の基質を反応させるので(「タ一ンオーバーが大きい」と言う),生成物に残る触媒量はごく僅かで,除去する必要がない.
家庭用品の包装などに巨大な量のポリエチレンなどが安価に使用できるのは,この触媒のおかげで,石油を原料に極めて安く製造できるからである.
錯体触媒の作用機構はかなり詳しく理解されるようになった.
その結果,単に新触媒発見への道筋が予測可能になっただけでなく,今まで理解の不十分であった不均一相触媒の作用機構を考察するのに役立つ情報も得られてきた.
有機金属錯休の中心金属原子と基質分子との相互作用は,固体触媒表面における金属原子-基質分子間の相互作用の模型ともみなしうるためである.
このように基礎研究,実用両面から錯体触媒の研究は重要であり,代表的な例について考察を進めることにする.
(3)ルイス酸触媒
錯体の中心金属原子はルイス酸であり,基質の負電荷を担う非結合電子対がこれに配位することによって電子密度に変化をもたらし,ルイス酸・塩基反応が促進される.
これについては,第12回で学び,金属酵素を触媒とする生体内でのアミド結合(ぺプチド結合)の切断の例をみた.(p.190)
このタイプの錯体触媒は置換活性な(p.168)ウェルナー型錯体に多くみられ,基質がキレート環を形成したり,水素結合で比較的安定な反応前駆体
(主反応に先だって生じる反応中間休で,この状態において主反応が起る)を生成する場合に顕著な触媒作用が認められる.
(4)ヒドロホルミル化反応
錯体触媒によって有機化合物の合成がスムースに進行する例は多いが,代表例として不飽和炭化水素と一酸化炭素からアルデヒドを造るヒドロホルミル化反応(オキソ法)を取上げる.
有機合成においてC-C結合をつくることは最も重要な過程で,各種の錯体触媒がこの目的に用いられる.
ヒドロホルミル化は一つの最も重要な方法で,現在全世界で800万トン以上の製品がこの方法で生産されている.
 (13.3)
(13.3)
生成物は直鎖と側鎖両異性体の混合物であるが,反応条件を調節すると比を変えることができる.
触媒としてオクタカルボルジコバル卜Co2(CO)8を用いた場合の反応過程を図13-3に示した.

実際の反応に際しては,Co2(CO)8から触媒活性の[CoH(CO)4]を生じる.
(5)錯体触媒の素反応
図13-3の反応経路は複維にみえるが,基本的には何種類かの素反応の組合せである.その中で重要なのは次の2種類である.
(a)配位子移動反応
(LM)一つの金属原子の上に配位したアルキル基が,隣の(シス位)配位座に配位したCO分子のC上に移動してC-Cを形成する.
図13-4に示したのはこの反応の中間状態であり,Co-C結合が緩んで,C-Cの生じる状況を模式化した.
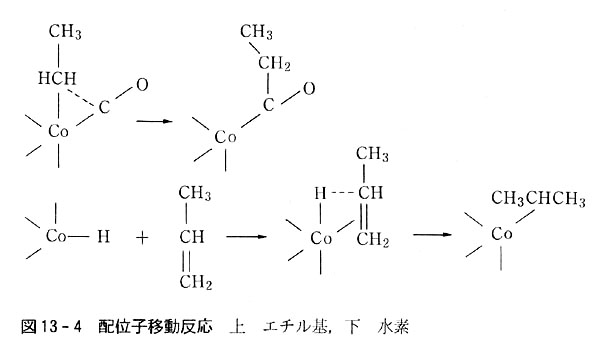
配位子移動反応には配位した水素原子(H-になっているとみなされる)が,隣の配位座にある二重結合の炭素原子上に移動するタイプもある.
その結果アルキル基を生じることになり,M-Cα結合ができる.
(b)酸化付加と還元説離
配位子移動反応が起る反応前駆体を生じるのは,配位子の置換反応(p.168)のほか,酸化付加(OA)と呼ばれる特殊な反応がある.
式(13.4)の例では,臭素分子Br2の共有結合が切れると共にイリジウム(I)イオンから2個の電子を奪って2個のBr-が生まれ,それが今生まれたIr3+に配位して配位数4が6に増加している.
trans-[IrICl(CO){P(Ph)3}2]+Br2→
[IrⅢClBrBr(CO){P(Ph)3}2](Ph=C6H5)(13.4)
このように中心原子の酸化数と配位数が同時に増加するのが酸化付加反応である.
臭素分子のほか他のハロゲン分子,ヨウ化メチルCH3I,水素分子などもこの反応を起こす.(H-として配位する)
また二重結合をもつ炭化水素ではC=Cは切れないが,一重結合に変化し,2つのM-Cα結合をつくる.
酸化付加の逆反応は還元脱離反応(RE)という.
配位した水素原子(H-の形を取っている)とアルキル基(R-となっている)から炭化水素RHを生じて配位座から離れ,その時合計2個の電子を中心イオンに渡してイオン価を2だけ減少させる.
またH-とCH3CO-からCH3CHOとなって脱離すればアセトアルデヒドができる.
(6)錯体触媒サイクル
触媒反応においては触媒活性物質が色々の化学変化を受け,自身が変化すると同時に基質に変化を起こさせる.
しかし触媒自休はもとの形にもどり,同様の変化を繰り返して多くの基質分子に化学変化を起こさせる.
繰り返し(サイクル)回数をターンオーバーという.
触媒が変質したり,別種の化学変化を生じてサイクルに戻れなくなればサイクルは終結する.
ターンオーバーの大きい触媒が実用上は有利である.
錯体触媒の場合はサイクル各段階での個々の化学変化が分かりやすく,反応経路を理解するのに便利である.図13-3を詳しくみよう.
(1) は[Co2(CO)8](ア)が水素分子と反応し,中間に[CoH(CO)4]を生じ,COを失って(2),触媒活性種[CoH(CO)3](ウ)を生じる反応である.
(3)ではこれにプロピレンCH3-CH=CH2付加して(エ)を生じ,(4)でH-がプロピレン上に配位子移動し,プロピル基がCH3CH2CH2-の形で配位した(オ)を生成する.
これにCOが配位して(カ)ができるが(5),C3H7-がCO上に移動して(キ)が生まれる(6).
これに水素分子H2が酸化付加して(ク)となり(7),これから還元脱離反応によってブタナール(ブチルアルデヒド)C3H7CHOが合成されると共に,元の触媒活性種(ウ)が再生する(8).
このようなサイクルが繰り返され,プロピレン,一酸化炭素および水素からブタナールが合成される.
なお,(オ)から(キ)のできる段階をみると,プロピル基とコバル卜の間に一酸化炭素が入り込んだ形となるので,「一酸化炭素が挿入される」という表現が合成化学者の間で用いられる.
しかし反応機構をみると決してC-Coの間にCOが挿入されるのではない.
この表現から誤解を生じないよう注意が必要である.
(7)チーグラー・ナッタ触媒
二重結合をもつ炭化水素(オレフィン類)の重合に用いられるこの触媒の作用も配位子移動反応が主要な役割を果たす(図13-5).
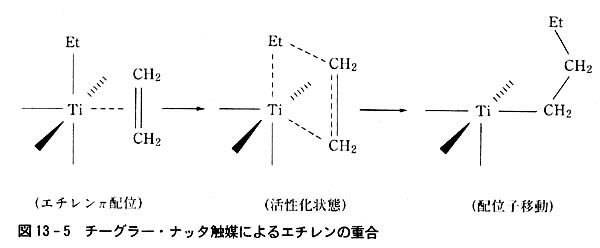
チタン原子上でエチル基EtがエチレンのC原子上に移動しC4の鎖が生じる.
この時あいた配位座にエチレンが配位し,その上にC4H9-が移動してC原子の鎖がC6に延び,さらに空配位座にエチレンが配位して順次C原子鎖が延びて分子量の大きいポリエチレンができる.
(合成の用語では「次々にエチレンが挿入して」と表現する.)
この夕一ンオーバーはきわめて大きく触媒1gからポリエチレン1tも生成する.
製品中に残留する触媒量はlppm程度になり,除去しなくても製品コス卜にはほとんど影響しない.
チーグラー・ナッタ法の優れた点の一つは大きいターンオーバーにある.
 (13.3)
(13.3)

