15章 欲しい物質をつくる
化学研究の重要な仕事の一つは必要な物質をつくり出すことである.
既に知られている物質を純粋に,大量にしかも安価につくり出すことはもとより大切であるが,新しい機能をもった物質を創造することはさらに一層重要である.
この分野一合成一は基礎化学研究の大きい部分を占め,また化学が他の学問分野と異なった特色を発揮する領域でもある.
最終回では新物質をつくり出す研究の進め方を概観し,先端的機能を志向した創造的研究の具体例をみよう.
1. 合成化学
合成化学という言葉の意昧は人によって解釈に差がある.
有機合成化学,無機合成化学という対象物質別の分類も可能だし,またかなり工業的な意昧に用いられることもある.
化学の他の分野と違って合成化学は体系化が不十分である.
系統化を目指した努力は懸命につづけられているが,新しい物質の合成は予期しない結果から生まれることも多く,「合成は意外性に依存している」などといわれる位である.
合成の対象となる機能性物質を概観し,化学反応の立場から合成経路を考えよう
(1)人類に必要な物質
人間は太古から色々の物質を活用して生活を支え文明を築いてきた.
今日の文明生活上必要な物質を,これまで学んできた化学の立場で分類すると表15-1のような整理が可能である.
新しい材料が現れると,用い方にも大きい変化が生じる.

例えば航空機の機体はアルミニウム合金(ジュラルミンなど)が主材料であると考えられてきたが,今日の飛行機には,ブラスチックスを各種繊推で強化した複合材料がそれ以上に多く用いられている.
機械的強度が大きく,軽量ですむからである.(映像)
(2)合成と化学反応
物質を変化させるには化学反応が必要で,化学反応の種類は無限といってもよいほど存在する.
しかし複雑な反応が一度に起こるわけではなく,段階的に順に進行する.
実際の反応を各段階ごとの反応に分けて考えて行くことを反応の解析という.
解析を進めて,もうこれ以上解析できないところに行き着いた時,その段階の反応を素反応という.
例えば臭化t-ブチルt-C4H9BrをアルカリOH-と反応させるとt-ブチルアルコールt-C4H9OHを生じるが,これを解析すると,まずC-Br結合が切れてC4H9+とBr-を生じ,つぎにOH-がC4H9+と反応して生成物を与えることが分かる.
C4H9Br→C4H9++Br- (15.1)
C4H9++OH-→C4H9OH (15.2)
2つの式で示されるのは素反応で,前者は結合切断,後者は結合生成である.
種々の反応を解析した結果,素反応は共有結合の切断または形成,および電子の移動に限られることが判明した.
どんな複雑な反応でも,個々の結合生成または切断,および電子移動という素反応の組合せとして理解できる.
それゆえ,素反応をうまく組み合わせれば求める物質が自由に得られることが期待される.
しかし実際の複雑な反応について各素反応を完全に掌握し,その発現を支配することはできない.
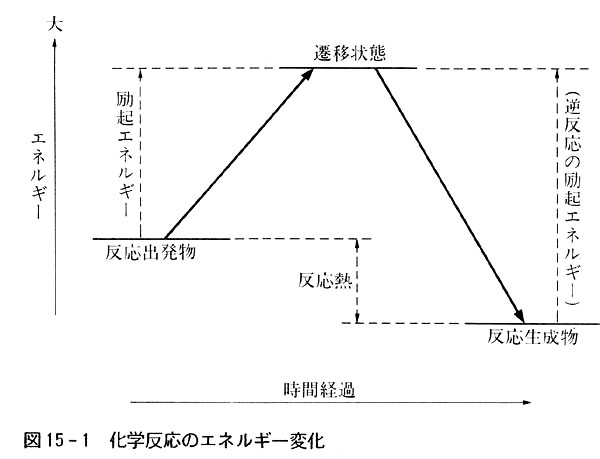
素反応が進行する途中ではエネルギーの高い中間の状態を通過しなくてはならず,この状態を遷移状態という.(図15-1)
(3)反応速度支配と化学平衡支配
実際の化学反応系を考えて行く上で重要なことは反応の速度である.
例えば,エチルアルコールは揮発しやすい可燃性の液体で火をつけると熱を発して燃えるが,空気中に放置してもすぐに燃え上がるわけではなく,安定に長い間存在する.
これはエチルアルコールと酸素との反応速度が通常の温度ではきわめて小さく,反応がほとんど全く進行しないためである.
火をつけたり,触媒を用いれば燃焼して二酸化炭素と水蒸気になり,大量の熱を発生するが,これはエチルアルコールと酸素が存在するより,二酸化炭素と水蒸気が存在する方がエネルギーが低い状態であることを示している.
つまり式(15.3)
C2H5OH+3O2→2CO2+3H2O (15.3)
では右辺が左辺より熱力学的には安定なのである.
それでも室温でエチルアルコールが空気中で化学変化を起こすことなく存在しうるのは,式(15.3)の反応速度が低いことが原因であり,このような場合を反応速度支配系という.
これに対し自動車エンジンのシリンダー中では,燃料であるガソリン、(炭化水素の混合物であるが,ヘプタンC7H16で代表させる)と空気が高温で反応し,ほとんどすべて二酸化炭素と水蒸気になっていて高い圧力を与える.
(窒素はほとんど反応しない)
C7H16+11O2  7CO2+8H2O (15.4)
7CO2+8H2O (15.4)
この場合では電気花火を飛ばして反応が起こりやすいようにしているし,一旦反応が起こり始めれば反応熱が生まれて温度が高くなり,反応速度はさらに大となる.
こうして式(15.4)は化学平衡状態に達している.
この平衡はずっと右辺に偏っているから,左辺の炭化水素はほとんど残らず,右辺の気体分子になってシリンダー内の圧力を高めるのに役立っている.
このように化学反応速度が大きくなって,化学平衡が成立するようになった場合を化学平衡支配系という.
これを模式的に図示すると図15-1のようになる.
化学反応に際して熱が発生するかまたは吸されるかは,反応物質と生成物質のもつエネルギーの差によってきまる.
この差が反応熱であり,適当な実験によって測定できることはp.166に述べた.
反応熱が大きく大量の熱が発生するほど右辺の状態が左辺の状態より安定であり,化学平衡は右辺に偏る.
(厳密には反応熱の差ではなく,反応に伴う自由エネルギーの差というべきである.くわしくはp.142,156参照)
これに対し,反応速度の大小を決定するのは,反応の進行途中で超えなくてはならない遷移状態と反応する物質のエネルギー差(励起エネルギー)である.
この値は反応熱と直接には関係のない量であり,平衡がどれだけ右に偏っていてもそちらに向かう反応が速いとは限らない.
すなわち,反応系が速度支配となるか平衡支配となるかは,各反応ごとに反応条件によって決定される.
(4)合成計画
各種の目的をもった物質を合成する時,どのような計画を建てるかは反応速度支配系であるか,化学平衡支配系であるかによって著しく異なる.
また使用する装置や,運転方法などの差も大きい.
ごく大ざっぱに分類すると,大部分の有機化合物,錯体など分子性物質の合成には反応速度支配系を利用することが多く,金属,固体無機化合物の合成は化学平衡支配系の利用が多い.
また化学分桁の目的や物質分離の目的である化合物を作ろうとする場合は,やはり平衝支配になるような条件を選ぶ.
しかしイオン結晶のような固体無機化合物を作る時にも,反応速度支配系を利用することもある.(p.229)
(5)反応場の問題
合成を行うに当たり,どの様な相で反応させるかも重要な間題である.
溶液を用いて液相で反応させる方法は有機化合物や錯体に広く用いられる.
反応条件を精密に制御し,反応速度支配系をコントロールしながら合成進めるのに適している.
また反応生成物を未反応原料や溶媒から分離するのに,再結晶,蒸留,昇華などの方法を用いることができ,純物質をつくるのに便利である.
その反面,高温,高圧などの激しい条件下で合成を進めることができない,また溶解度が低くて,ごく希薄な溶液でしか反応させられないという制約を伴うこともある.
気相の反応は容器の関係もあって実験室では余り便利ではない.
しかし反応速度が大きくて,一定温度・圧力に保った容器の一方の口から原料ガスを流し込み,他方の口から生成物を取り出せるような場合は,工業的な大規摸合成に適している.
ことに生成物を原料や触媒から簡単に分離できる場合は操作が簡単な長所がある.
固相での反応は固体無機化合物の合成に広く用いられる.
多くは化学平衡支配系に適用され,高温で反応速度を十分に大きくし化学平衡状態をつくり出す.
この場合,未反応の原料や副反応生成物からの分離が困難という短所がある.
先端材料など,高純度の製品が求められる場合,精製操作が重要となる.(p.228)
以下は先端材料合成の具休例をとりあげ,新物質を設計し合成して行く研究の進め方をみよう.


 7CO2+8H2O (15.4)
7CO2+8H2O (15.4)