第3章 いろいろの分子
分子という言葉の意味を少し広げると,「一定数の原子が結合した集団で,1個の独立した粒子として行動する物」と定義できよう。
電荷を持つイオン,不安定分子で短時間しか存在できないものもこの中に含まれる。
また錯体(第11回)分子の中には原子数が数十に及ぶものもある。
非金属元素の作る分子の形はいろいろであるが,一つの原子を中心に見立て,他の原子はその周囲に配置されるとみなすことによって系統的に理解しやすい。
分子内での結合状態は,分子の諸性質を説明しやすいようLCAO法で近似する。
重要な分子には水素化物,ハロゲン化物,酸化物などのほか,非金属元素と酸素の原子からなるオキソ酸イオンがある。
炭素は多種類の有機分子を与えるが,窒素の硫化物,ホウ素の各種化合物にも独特のものがある。
1.分子の形
(1)分子形の分類
分子の形は実験的に精密に決定できるが,形が問題となるのは3原子分子以上である。
構成原子数の少ない場合は表3-1のように整理できる。
(この時正規の形からの僅かのずれは無視する。例えば,塩化メチルCH3Clは正確にいうとC-Cl距離がC-H距離よりやや長く,“正”四面体とはいえないが,メタンCH4と同じ正四面体に分類する。)
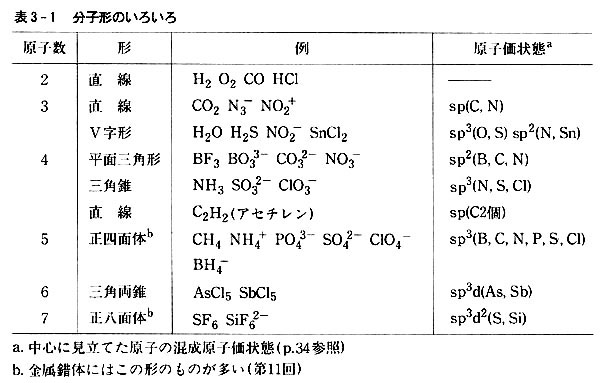
表3-1を理解しやすくするために,直線形なら中央の,V字型なら頂点の,三角形,四面体,三角両錐,八面体なら中心に位置する原子を「中心原子」と見立て,他の原子はその周りに配置された「周辺原子」とみなす。
水素原子は常に周辺原子であり,酸素原子もほとんど常にそうである。
ハロゲン原子は酸素原子を相手とする時以外はやはり周辺原子となる。
硫黄は時に周辺原子となることがある。
他の原子はほぼ例外なく中心原子に見立てられる。水素原子を除くと,大体において電気陰性度の大きい方の原子が周辺にくる。
(2)電子対反発則による説明
表3-1の形はかなり直観的に理解可能である。
中心原子の周りには周辺原子との結合電子対および結合に関与しない非結合電子対が存在するが,それら電子対の向く方向は相互反発が最小になる方向だと考える。
電子対は負電荷を持つからこれは当然である。
電子対の数が2,3,4,6の時はそれぞれ直線,正三角形,正四面体,正八面体の頂点方向に向く。
5の時は四角錐と三角両錐の可能性があるが,実際はほとんどすべて後者である。
正三角形の頂点の一つが非結合電子対で占められれば,分子形としてはV字形になる。
中心原子周りの電子対数は次のようにして決定される。
(π結合(p.48)が考えられる酸素原子が周辺原子となる場合は後述する。)
周辺原子が水素またはハロゲン原子の時はそれらから各1個の電子が結合対形成に参加する。
中心原子からは主量子数最大の電子軌道にある電子はすべて結合対または非結合対形成に関与する。
これらをすべて加えた電子数を2で割ると形成される電子対総数が得られる。
これが上記のような配置をとると考え,その相手として周辺原子を置く。
相手原子のない電子対は非結合対になる。
中心原子からみて周辺原子が何個かを示す数を配位数という。
(この言葉は幾何学的な意味で,原子間の結合の種類は問わない。)
この方法は簡易原子価による方法と呼ばれ,粗い近似であるが,構造のわかった分子がその形をとる理由を説明できるだけでなく,構造不明な分子の大体の形を推定するのにも役立つ。
ただし応用できる範囲は,鎖や環を作らない反磁性分子に限られる。
(3)分子形推定例(表1-4,p.21参照)
a)メタン CH4:中心原子C,周辺原子H.
Cの最大主量子数2を持つ電子4,H4個より電子4,電子対を作る電子計8個,4対。
それらの配向方向はCから正四面体の頂点方向。H4個が占める。
b)アンモニア NH3:中心原子N,周辺原子H.
Nの最大主量子数2を持つ電子5,H3個より電子3,電子対を作る電子計8個,4対。配向方向はNを中心とする正四面体の頂点方向。
そのうち3個はHで占められ,1つは非結合対。三角錐形。
c)六フッ化硫黄 SF6:中心原子S,周辺原子F.
Sの最大主量子数3を持つ電子6,F6個より電子6,電子対をつくる電子計12,6対。配向方向は正八面体の頂点方向。
F6個が占める正八面体形。
酸素原子が周辺原子となる時は,後述のπ結合(二重結合)を考える必要があり,幾らかの補正を要する。
基本的考えはπ結合の存在によっても変わらない。
d)炭酸イオン CO32-:中心原子C,周辺原子O.
後述図3-4のように,Cに=O1個,-O−2個が結合したとみなす。
2個の-O−の結合に関与する電子は各1個である。
=Oは2個の電子が関与しうるので,結合対を作る電子総数は4+2+2=8となり,4対が生まれる。
しかし1対は全体としての分子形には影響しないπ結合を作るので,これを一応除外し,3個の電子対がCからみて正三角形の頂点方向に向く。
そのうち2個は-O−で,1個は=Oで占められる。
e)硫酸イオン SO42-:S(=O)2(-O−)2と書けるから炭酸イオンの場合と同様,Sから6個,=O2個から4個,-O−2個から2個,計12個が6対を作るが,π結合用の2対を除いて4対が形を決定する。
これらが正四面体の頂点方向を向き,正四面体形分子を作り,2個は=Oで,2個は-O−で占められる。
(4)小分子の形
非金属元素の作る分子の多くは,直線,正三角形,および正四面体を基本とした形で,頂点の一部を非結合対が占める場合もある。
すなわち配位数は4以下のことが多い。
配位数が5以上となるのは,リン,硫黄など周期表の第3周期以後の原子が中心原子となる場合で,その時は3d軌道の電子が混成原子価状態に参加する。(表3-1)
