2.分子内結合の近似
非金属原子間の共有結合をLCAO法で近似する方法はp.32に述べたが,それを種々な分子に適用した場合を考察する。
(1)非結合対を生じる場合
図3-1にはアンモニアNH3のLCAO近似を示した。
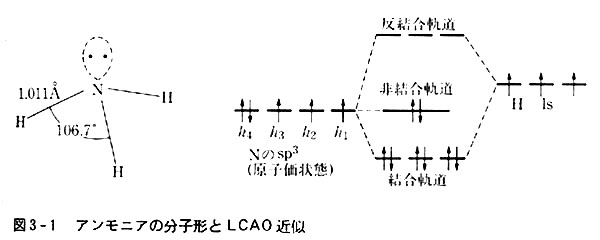
分子構造は図示のとおりで3個の水素原子は同じ位置にある。
つまり等価であるから,水素の原子軌道は同一のものが3本あることになる。
これと原子価状態h11h21h31h42窒素との間にLCAO近似を行うと,3本の結合分子軌道と3本の反結合分子軌道が生まれる。
h42は結合に与らない非結合軌道となる。
そのエネルギーレベルは原子軌道の時と変わらない。
アンモニアの∠HNHが106.7°と正四面体の場合よりやや小さいのは,非結合対と結合対との間の静電的反発は,結合対どうしの反発より強いと考えれば説明できる。
非結合対は相手がないので窒素原子に近い所に存在するから,他の電子対との反発が著しくなるのは当然である。
水もアンモニアと同じ様なLCAOで近似される。
この時は,酸素原子が原子価状態h11h21h31h42となり,等価の水素原子は2個,非結合分子軌道は同じエネルギーのもの2本となる。(2重縮退[または縮重]した状態という)
∠HOHが104.5°と小さくなっているのは,非結合対どうしの静電的反発はさらに顕著だからだと理解される。
(水分子の分子構造を説明するのに,sp3原子価状態を考えず,基底状態の2s2px1py1pz2のp軌道2本と2個の水素原子の間にLCAO近似を行う方法もある。)
この時も非結合軌道2本を生じるが,それらは2重縮退せず,形の異なる軌道となる。
この時∠HOHが90°でないのは,H原子どうしの反発によると考える。
どちらの近似がより妥当であるかは,水分子の物性,特に非結合対に由来する性質を説明するのにどちらが良いかによって快定すべきである。
(2)二重結合を考える場合
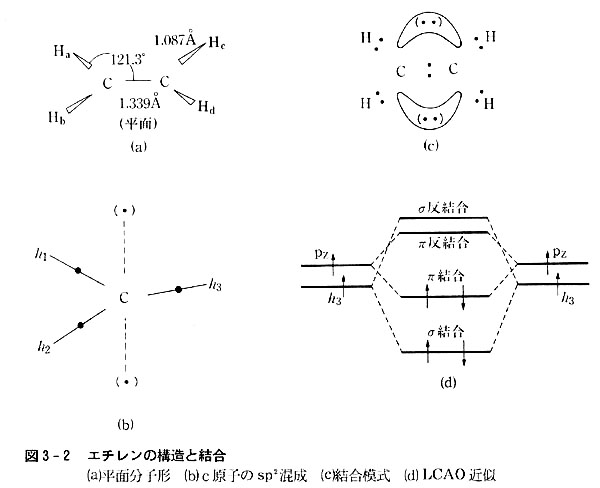
炭素と水素の原子からなるエチレンC2H4は平面分子で図3-2のように,炭素原子からほぼ正三角形の頂点方向にH2個と炭素原子が結合している。
臭素,塩素などの分子と付加反応を起こしやすいなどエタンとはかなり異なった性質を持ち,不飽和炭化水素と呼ばれる。
その結合は図のように近似できる。
2個の炭素原子はどちらもsp2混成原子価状態h11h21h31px1をとり,混成軌道の不対電子3個は正三角形の頂点方向に共有結合を作る。
相手は水素原子が2個,炭素原子が1個である。
混成に加わらないpxの不対電子は,隣の炭素原子のpx軌道にある不対電子と結合対を作るが,その結合性分子軌道はC-C軸方向でなく,CとHの作る平面と直角の方向に存在し,バナナ形を取る。
このように原子をつなぐ軸から直角の方向に生じた共有結合をπ結合という。
また同時に生まれる反結合軌道は結合軌道と同じ面内で,隣のC原子とは反対の方向に向く。
このようにsp2混成を考えると,通常のC-C結合軸方向に生じる共有結合―σ結合という―とπ結合と二重に結合を生じたことになる。
二重結合を考えるとエチレンだけでなく平面構造を持つ不飽和炭化水素類の構造を説明できる。(図13-2,p.198)
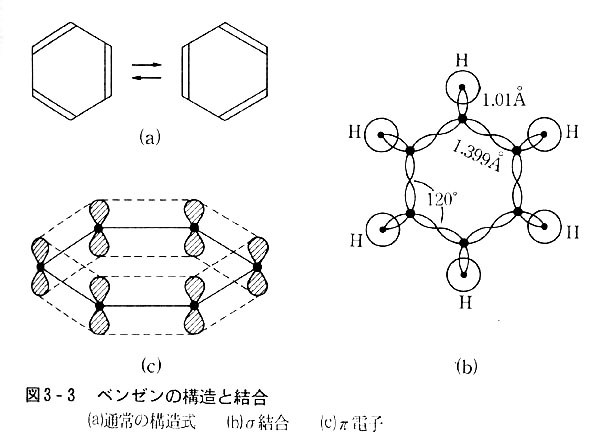
形式的な二重結合を持つ炭化水素にベンゼンがある。
この分子は平面正六角形で水素原子は面内で外に向いている。
C-C距離はいずれも1.399Åで,6個の炭素原子はすべて等価である。
従って一つおきに二重結合を書いた六角の構造式は正確でない。
この場合も炭素原子にはsp2混成原子価状態を考え,h11h21h31は炭素原子2個,水素原子1個を相手として正三角形の頂点方向に通常の共有結合―σ結合―を作ると考える。
エチレンの場合と異なるのは,π結合を特定の炭素原子間に考えるのではなく,6個の炭素原子から生まれた混成にあずからないpx軌道電子6個が一体となってπ結合を作ると考える点である。
このπ結合を「共役した二重結合」といい,π結合に関与する電子は特定の炭素原子上に存在せずに,六角の面と直角の方向に環状に存在する。
このように,非局在の電子によるπ結合を考えるとベンゼンの諸性質をうまく説明出来る。(図3-3)
環状に非局在化したπ結合を持つ化合物は芳香族性があるという。
その例はベンゼン以外にナフタレンC10H8,ピリジンC5H5Nなどの6員環を持ついわゆる芳香族炭化水素およびその誘導体があり,7員環のトロポロンなどもその仲間である。
無機化合物にも芳香族性を持つものがある。
π結合に参加する電子数が[4n+2個(nは整数0,1,2……)]であるとき芳香族性が認められるという。(ヒュッケルの法則という。p.54)
(3)官能基
原子数を多く含む分子では,分子中にグループを考えた方がよい場合が多い。
OHはそれだけでは安定に存在しないが,多くの有機・無機分子中で一つのグループとして安定に存在する。
また炭素原子に水素原子が結合したメチルCH3,エチルC2H5などの炭化水素基と呼ばれるグループは多くの有機分子に含まれ,その分子が反応する時もそのままの形で残り,生成した分子に移ることが多い。
このようなグループを「基」と呼ぶ。
基は・OH,・CH3のように不対電子を持ち,その不対電子が他の基の不対電子と対を作って,共有結合を形成する。
基の存在を考えるのは有機分子に限らないが,ほとんどすべての有機化合物は基の組み合わせでできると考えてよい。
有機分子を作る基のうち,アルコール類を与える水酸基OH,カルボン酸を作るカルボキシル基COOH,アミン類やアミノ酸の元となるアミノ基NH2のように,分子に一定の性質を与えるような基を官能基という。
官能基でない基の代表はアルキル基CnH2n+1である。
有機化合物は官能基の種類に基づいて分類するのが便利である。(「基礎化学」第6回参照)
(4)オキソ酸とそのイオン
酸類は日常生活にも工業上も極めて重要な物質であるが,その中には硫酸H2SO4,硝酸HNO3,過塩素酸HClO4をはじめ,多くの種類がある。
それらは非金属元素原子を中心にして酸素原子が周辺原子として位置し,陰イオンを生じてそのO原子上にいくつかのH原子が結合している。
多くは水に溶けやすく,水溶液中では電離してH+イオン(実際は水分子と結合してH3O+となっている)を生じやすい。
このような酸をオキソ酸,その陰イオンをオキソ酸イオンと呼ぶ。(オキソ酸のことを酸素酸ということもある。)
オキソ酸イオンは極めて規則正しい形を持ち(対称性が高いと表現する),水溶液中でも構造が変化しない。
その結合状態をLCAO法で近似する例を炭酸イオンCO32-について図3-4に示す。
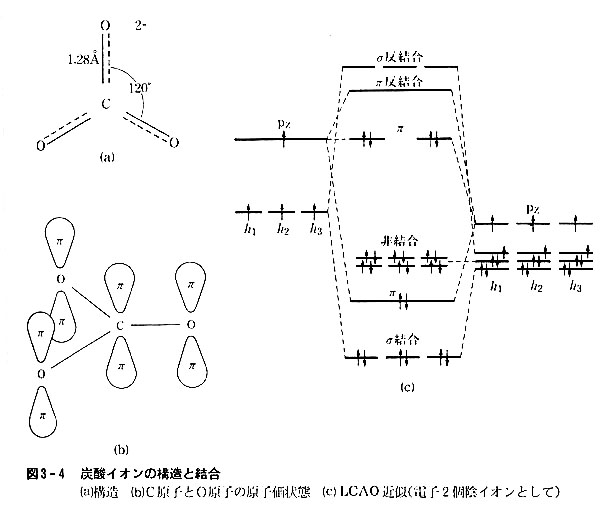
形式的に電価を考えると[C(=O)(O−)2]2−となるが,C-O距離はすべて1.25Åで酸素原子3個は等価である。
炭素原子にはsp2混成を考え,原子価状態をh11h21h31pz1とする。
また酸素原子もsp2混成をとるとし,原子価状態をh11h22h32pz1とする。
C-O間に3本のσ結合が形成され,pz方向でπ結合が生まれるとして画いた分子軌道は図のようになる。
エネルギーの一番低いσ軌道はC-O軸上にあるが,かなりO原子の方へ偏っている。
それらは相殺して全体としては無極性である。
非結合軌道は酸素原子上のh22h32に由来する。
π軌道はすべてCO3分子面とは直角方向に広がっている。
正三角形の硝酸イオンNO3−もほぼ同様に近似できる。
しかし硝酸HNO3はHと結合したC原子は他の2個と等価でなくなる。
オキソ酸の酸としての強さについては第4回で扱う。



