第4章 小分子の集団
分子が集まって液体や固体を作ると単分子の時には考えられなかった新しい性質が現れる。
分子どうしの間に働く結合力は分子内で原子間に働く力とは全く別種のものである。
分子間力には普通の分子間に働く一般的なものと,特殊な分子間にだけ作用するものとがある。
前者の大きさは主として分子の双極子モーメントと分極率によって支配される。
後者として重要なのは電荷移動に基づくものと,水素原子を媒体とする水素結合である。
電荷移動力は通常の分子集合体(液体・固体)には見られない物性をもたらす。
水素結合は氷や水溶液の性質を支配する重要な因子で,地球に特有な現象の原因となっており,人間生活もその影響を大きく受けている。
1.分子間力
分子の間に働く力を分子間力と総称する。
通常の場合個々の分子間に作用する力の大きさは,分子内の原子間に働く化学結合力に比べれば著しく小さい。
その種類は分子の種類によって色々であるが,本質的には静電的なもので,主な種類は次のようである。
なお分子が極めて接近した時は強い反発力が働くが,これも分子間力の一種である。
a)配向効果 静電的双極子モーメントを持つ分子どうしの間に働く力で,その大きさは双極子モーメントの4乗に比例し分子間距離の6乗および温度に反比例する。
各分子の双極子の正・負電荷間の静電引力が原因である。
当然ながら無極性分子間には働かない。
b)分散力 分子内で各原子は熱振動しており,瞬間的には電荷の偏りを生じている。
こうして生まれた双極子モーメントの間に働く引力を分散力という。
瞬間的な双極子モーメントの大きさは分子の分極率が大きいほど大きい。
この力はすべての分子間に働き,やはり分子間距離の6乗に反比例する。
c)誘起効果 双極子モーメントを持つ分子は他の分子を分極させる力を持つから,極性分子どうしの間に働く配向効果の他に,誘起された双極子と本来の双極子モーメント(永久双極子)との間に静電引力が作用する。
永久双極子が大きいほど,また分極率が大きい程この効果は大きい。この力もまた距離の6乗に例する。
分子間引力の強さを近似的に示すのが式(4.1)である。
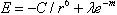 (4.1)
(4.1)
この式はロンドンの近似式というが,第2項は通常の分子結晶における
分子間距離では著しく弱い。
この他にも四極子モーメントに基づく引力なども作用するが,主な力はa〜cの3種である。
これらは何れも距離の6乗に反比例し,少し離れると急速に弱まってしまうのが特色である。
このような分子間引力をファン・デル・ワールス力ともいう。
表4-1には無極性,極性の分子の代表例について,双極子モーメントμ,分極率α,沸点,融点を示した。
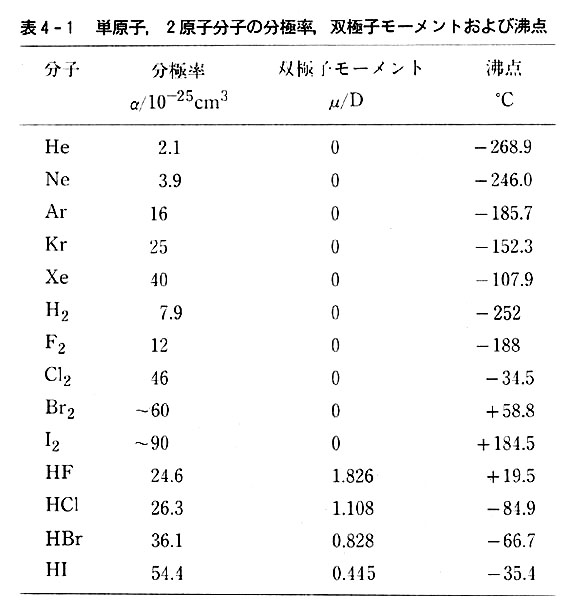
沸点が高いことは,分子間引力が大きいため,高温になって分子の熱運動が盛んになってはじめて,分子がばらばらの気体になることを示す。
無極性分子では分極率が,極性分子ではそのほかに双極子モーメントが大きく影響していることが分かる。
フッ化水素が著しく高い沸点を示すのはp.63に述べる水素結合の影響である。
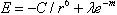 (4.1)
(4.1)