3.水素結合と氷
特殊な分子間に働く力として重要なものに水素結合がある。
電気陰性度の大きい原子を持つ分子の間に水素原子が存在すると,その原子を介して分子間にかなり強い力が働く。
フッ素,酸素など周期表の右上方の元素が作る水素化物に顕著である。
特に水分子が水や氷を作る時に重要な意味を持つ。
(1)水素結合
表4-2に非金属元素水素化物の沸点を示した。
p.57に述べたように,分子間のファン・デル・ワールス力は主として分子の分極率と双極子モーメントによって支配され,同一族では原子番号の大きい元素の水素化物ほど沸点が高くなる傾向がある。(表4-1)
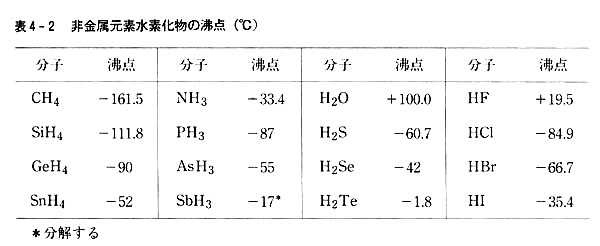
しかし最上段の元素については,水素化物の沸点が例外的に高い。
元素の電気陰性度は同族では上に行くほど大きくなり,それら原子の水素化物は隣り分子の水素原子を引き付ける程度が増加するが,原子の非結合電子対の部位が水素原子と相互作用する。
こうして1.に示したのとは別種の分子間引力が働いて沸点が上昇する。
最も水素結合が顕著なのはフッ化水素で,気体でも会合し2量体または5量体として存在する。
次に著しいのは水であり,液体の水および氷の特性は水素結合によって説明できる。
4B族元素の水素化物は双極子モーメントを持たず,非結合電子対もないので分子間に水素結合は働かず,原子番号の増加とともに単調に沸点が高くなる。
(2)氷の構造
水分子が作る固体が氷であるが,温度・圧力の条件によって,結晶構造の異なる氷が何種類か存在する。
しかしここでは最も普通の氷を取り上げる。氷の結晶は六方晶系に属し,雪の結晶が美しい六角形の対称を持っていることはよく知られている。
図4-3には氷の結晶の模式図を示した。

水分子の酸素原子に着目すると極めて規則正しい配列を持っており,一つの酸素原子の周囲は4個の酸素原子で正四面体に取り囲まれている。
原子間距離は約2.75Å,∠OOOは正四面体角109°28′に極めて近い。
このような配置が三次元につながって六方晶系の結晶を形成している。
しかし,水素原子の位置は全く不規則である。
その位置はO-O線上でO原子から約1.01Åの所であるが,1個のO原子に対しては2個のH原子しか無いから,O-O上には平均して1個のH原子しか存在しない。
つまり2個の可能な位置の片方だけがH原子で占められ,一方は空になっている。
H原子の位置は不規則性だが,平均するとすべての可能な位置に0.5個の水素原子があることになる。
このような状態を半水素という。
このような構造を調べるにはX線回折法を利用する。装置の詳細は第7回に映像で説明する。
(3)氷の格子欠陥
実在の氷の結晶は図4-3(a),(b)のような規則正しいものではなく,色々の不完全さを持っている。それらを格子欠陥と総称する。
局部的な水素原子の位置に偏りを生じ,1個のO原子にH原子が3個結合したり,1個だけしか結合しなかったり,H+が結合してH3O+が生じたりする。
後者の場合は同時にOH-も生じ,水分子の自己電離が生じたのと同じようなことになる。
これらの変化は点欠陥と呼ぶが,Ⅹ線でも観測することは出来ない。
氷にいくらか電導性があるのは,このような欠陥と関係している。(図4-3(c),(d))
一方,O原子の配置にも欠陥が存在する。1本の線に沿ってO原子の欠落が生まれ,くさびのような欠陥の連続が生じる現象は線欠陥の一種であり,多くの結晶に見られる。
この刃状欠陥は氷の機械的性質(変形しやすさ,弾性など)に関係が深いが,それについては第7回で,金属の結晶と一緒に考えることにする。(p.111)
特殊なⅩ線回折法を用いて撮影した氷の格子欠陥ことに線欠陥の状態は映像で見ることにする(図4-4)。



