第5章 金属元素と非金属元素の境界にそって
元素周期表のホウ素からテルルに向かっての斜線付近の諸元素は中間的な性格を持ち,単体も化合物も独特の性質を示す。
そのため物質構成を考える上での基礎的立場はもとより,応用という面からみても極めて重要な意味を持つ。
個々の物質については,物質工学の立場からの科目も計画されているので,本章では物質構造の面で考察する。
1.単体の構造
(1)変態の存在
周期表の左方の元素は金属性の,右方の元素は非金属性の単体を与え,その境界は大体において,ホウ素とテルルまたはポロニウムを結ぶ斜線とされている。
しかしこの境界線付近の元素は構造の違った分子や結晶―変態―を生じやすく,しかもそれらどうしの間の性質の差が著しい。
性質の一つの目安として電気伝導性に着目すると図5-1のように整理できる。
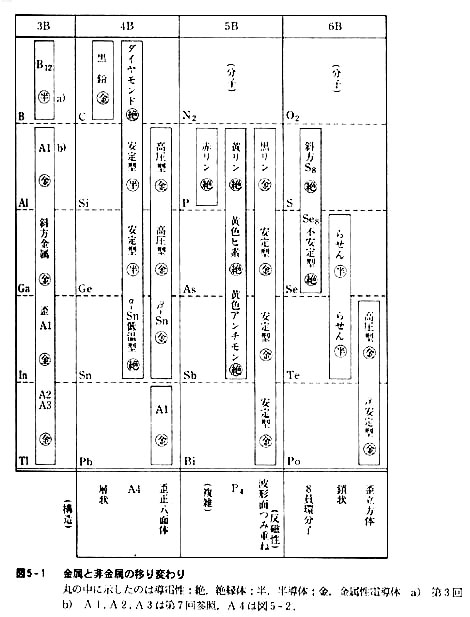
図は主要な変態だけを取り上げたもので,すべてを尽くしてはいないが,金属性のシンボルである金属性電導―温度上昇に伴い電気抵抗増加―,非金属性の代表である絶縁性を示す分子や固体結晶のほか,両者の中間的性質である半導性―温度上昇に伴い電気抵抗減少―の固体をも生成する。
図を詳細にみると,周期表の左方に行くほど,原子番号の小さい原子でも半導性および金属性電導の変態を生じるのが分かる。
逆に右の方の元素は原子番号の大きいものだけが半導性または金属性電導の変態を与える。
つまりB-Teを通る斜線が大体の境界であるが,境界は1本の線で示されるようなものではなく,かなり幅を持った境界領域と考えるべきものである。
境界領域にみられる単体の特色は,共有結合が少数の原子間に限定されず,多数の原子を結び付けている変態を持つことである。
原子は多数集まってはいるが,個々の原子に着目すると化学結合が一定の方向に生じている点で金属結合やイオン結合とは本質的に異なる。
また同族元素が同一構造をとる傾向も著しいが,このことは化学結合にあずかる外側の電子配置が類似していて,構造がそれに支配されていることの現れである。
(2)ジントル相
単体の構造が外側電子の配置によって決定されることは,ジントル相という独特の固体が存在する事実にもみられる。
表5-1のように,3B族原子の1価陰イオンは,4B族原子と同じns2np2電子配置を持つようになるが,ダイヤモンドと同じA4型格子を作り,その隙間に相手陽イオンを含むイオン結晶(第8回)を形成する。

またケイ素,スズ等の1価陰イオンは5B族と同じns2np3電子配置となり,4個集まって黄リンP4と同じ形を持つ四面体型陰イオンSi44−を与え,Na4Si4(組成式はNaSi)等のイオン結晶を生じる。
このように電子配置と立体構造が密接に関連しているのは共有結合の特色である。
(3)炭素の特性
炭素にはダイヤモンドと黒鉛の2変態があることはよく知られている。
2s,2p電子が,それぞれsp3,sp2の混成原子価状態を取って共有結合を結成したと解されるが,両者の間のエネルギー差は1.90kJmol-1(黒鉛が安定)にすぎない。
これらの混成原子価状態は,それぞれ脂肪族・芳香族炭素化合物における炭素原子のそれに対応する。
黒鉛では正六角形平面状の層が図5-2のように重なるが,平面と直角の方向には混成に参加しなかったp電子(構造平面とは直角方向に存在するという意味でπ電子という)が存在する。

単結晶の電気伝導性は平面に平行な方向では金属性電導((4〜7)×10-5Ωcm)を,直角方向では半導性((1〜5)×10-1Ωcm)を示す。
また多結晶は半導体である。
層間の結合は弱いので層どうしははがれやすく,黒鉛は減摩剤に用いられる。
鉛筆の芯にも使われるが,滑りがよいのはこの層構造のためである。
黒鉛の層間にはアルカリ金属などの金属原子や,臭素Br2,五フッ化ヒ素AsF5のような非金属分子が取り込まれることがある。
この時層をなしている炭素原子は電子受容体または電子供与体として働き,これら層間化合物は特色ある物性を示すことが多い。
ダイヤモンドは物性や不純物によって何種類にも分類されるが,いずれも電流の絶縁体である。
しかし熱伝導度は極めて高い。
(室温で〜2000Wm-1K-1。)
一般には導電率の高い物質が熱伝導度も高いが,ダイヤモンドは例外である。
自由電子(p.109)ではなく,結晶格子の振動が熱を伝導するためである。
このタイプの熱伝導体には窒化アルミニウムAlNなどがあり,電子工業では重要な役割を担っている。


