第7章 金属の構造と特性
自然界に存在する元素約100種のうち3/4は単体が金属である。
金属は独特な外観と物性を持ち,一部は古代から人類文明の基盤を支えてきた。
金属結晶中では原子は規則正しく配列しており,原子間には金属結合が働いて自由電子が存在する。
金属の電気的および光学的性質の多くは自由電子の働きと関係が深い。
実在の金属結晶は決して完全ではなく,種々の欠陥(格子欠陥)が存在する。
金属の機械的性質の多くは格子欠陥とくに線欠陥と関係が深い。
2種以上の金属あるいは金属と非金属を混合すると合金を生じる。
これは金属原子の占める格子点が他の金属原子または非金属原子で置き換えられたり,結晶格子の隙間に非金属原子が入り込んだりするからである。
このような現象を調べるには多相平衡図(状態図または相図ともいう)が便利である。
1.金属の構造
金属の種類は極めて多く,性質も多様である。水銀のように常温で液体のものから,融点が3000℃を超えるものがあり,簡単に変形する物から極めて硬いものまである。
しかし結晶中での原子の配列は単純で,大部分の金属では球をぎっしり詰め込んだ状態に近似し得る。
(1)球の最密構造
同じ大きさの球を平面上にきっちり並べると正三角形をつなげた形に配列する。(図7-1(a))
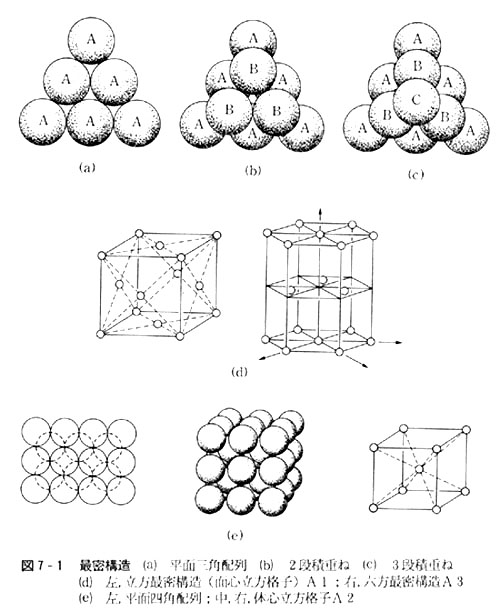
この上に同じ球を載せると,下段の球3個で作る窪みに球が並び,やはり正三角形をつなげた形に配列する。
第3段目にさらに同じ球を載せるには2種の載せ方が可能である。
第1の方法は第1段目の球の真上に並べて行く方法である。
こうすると第4段目は第2段目の真上に来て,2段毎の繰り返しとなる。(図7-1(b))
第2の方法は第1段目の球の真上を避けて3段目を並べる方法である。
この方法では4段目が1段目の真上に来る。これをさらに上の段まで繰り返すと3段毎に上下に揃った配列を生じる。(図7-1(c))
前者は六方晶系に属する結晶となるので,六方最密構造(記号はA3),後者は立方晶系結晶となるので,立方最密構造(A1)と呼ぶ。
この2種の配列では空間の約73%が球で占められる。
立方最密構造を別の方向からみると,立方体の各頂点と各面の中央に原子が位置していることが分かる。
それでこれを面心立方格子ともいう。(図7-1(d))
図7-1(e)の配置は球4個で正方形を作り,それを積み重ねたものである。
第2段目の球は下段の4個の球が作る窪みに入り,第3段目の球は第1段目の球の真上にくる。
この配列を持つ結晶は立方晶系に属するが,立方体の各頂点と中心を原子が占めることになるので体心立方格子ともいう。(記号A2)
の配列では球の実体積が空間の約64%を占める。
(2)最密構造の隙間
図7-1(b)および(c)の球の間には,2種の隙間が存在する。
一つは4個の球で囲まれた空間で,四面体孔(記号T)と呼ぶ。
今一つは6個の球で囲まれており,八面体孔(記号O)という。
図についてみるとA3構造では下から球−T−球−T−のように重なり,Oは上下に細長い管のようになっている。
これに対しA1構造においては,下から球−T−O−T−球−T−O−T−のように重なる。
A2では,すべての隙間がOである。
これらの隙間は純金属の完全な結晶においては単なる隙間にすぎないが,ある種の合金(侵入型または介在型という)では,この隙間に小型の原子が入り込むし,結晶格子に欠陥を生じる時には重要な働きをする。
またイオン結晶においては,隙間の一部または全部を対イオンが占めることが多い。(p.122)
1個の原子の周りに何個の原子が存在するかをみると,(この数を配位数と呼ぶ)A1,A3では12,A2では8となる。
(3)単体金属の構造
金属元素の単体で構造の分かっている種類は約80種であるが,そのうち約70種は上記3種の構造,A1,A2,A3のいずれかを持つ。
金属単体の中には温度・圧力によって構造が変化する(変態)ものも多いが,それらも大部分は3種の構造の間での変化である。
超ウラン元素や非金属性をも持つ元素(第5回)の単体を除くと,3種以外の構造をとるのは,マンガン,ガリウム,インジウム,スズ,ビスマス,水銀だけである。
つまり金属元素の単体は球をできるだけ密に詰め込んだ構造をとる傾向が著しい。
これは金属原子間に働く結合力が,方向性を持たないことと関連している。
例外の金属もA1,A2,A3のどれかに類似した構造を持つ。
(4)金属結合半径
原子の大きさは決して一定したものではなく,どのような結合を作るかによって変化することはp.42で述べた。
単体金属においては,実測された原子間距離の1/2を金属結合半径とする。
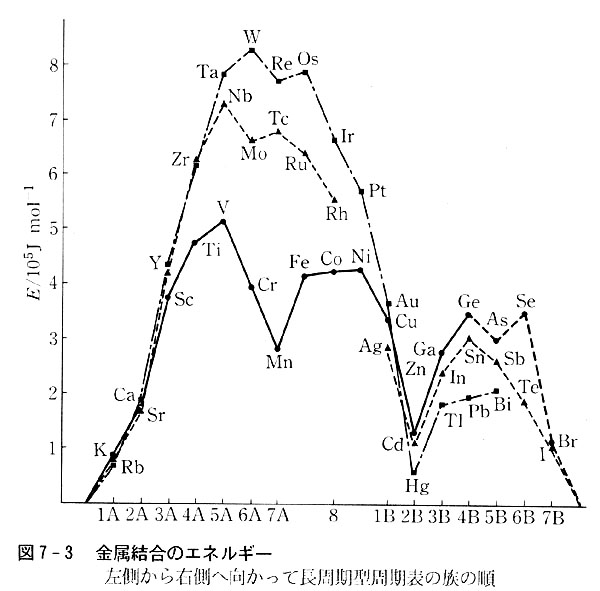
その値は図7-2に示した。
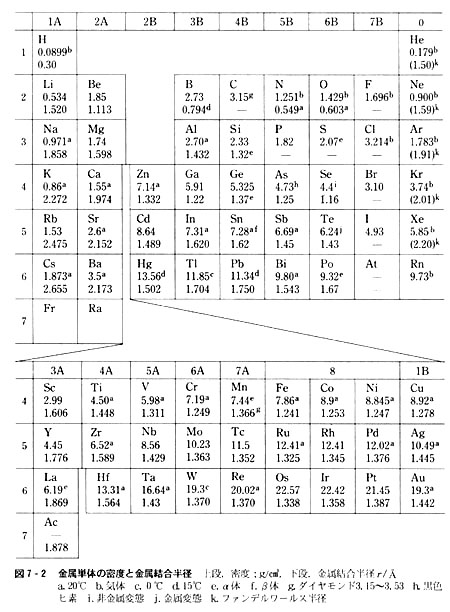
この図表では周期表を少し変形し,上段に典型元素を,下段に遷移元素を並べ,ランタノイドおよびアクチノイド元素は最下段に示してある。
この形式は典型元素どうし,遷移元素どうしを比較するときに便利である。
特殊な構造を取るものを除き,A1,A2,A3型のものでは,かなり顕著な規則性が認められる。
各亜族ごとに原子番号の増加に伴って金属結合半径は単凋に増加し,同じ周期では典型元素・遷移元素ごとに,表の右に行くほど半径は減少する。
しかし遷移元素では8族から1B族に移る所で増加する。
増加・減少の程度にはかなりの差があるが,これは変態ことに配位数の違いと関係がある。
一般に原子間隔が小さいほど原子間の結合は強固だと考えられるが,この点は密度・融点・気化熱などと相関がある。(図7-3)