2.金属の物理的性質
金属の機械的・熱的・光学的・電磁気的性質は実用面から極めて重要であり,種々の条件下で測定されている。
しかしその問題は材料関係の専門科目で詳しく扱われるので,この科目では結合と関連した基本的な点だけに絞って考察する。
機械的性質は金属結晶の不完全さ(格子欠陥)と関係が深いのでp.110で,化学的性質は第10回で取り上げる。
(1)融点・沸点・融解熱・気化熱
金属の物性は結晶状態に依存する程度が大きく,また高温での測定技術の問題もあり,測定者によって値が必ずしも一定にならない。
即ち少量の不純物や格子欠陥の存在,別の変態の混在,小さい結晶の集合状態などが結果に影響を与える。
特に格子欠陥の存在は不可避で,データのばらつきは宿命といえよう。
金属の気化は金属結合が切れて個々の原子を生じる変化で,金属結合の強さを反映しており,分子結晶の気化とは本質的に異なる現象である。
これに対し融解に際しては金属結合はいくらか緩むが全く切れるのではないから,融解熱は気化熱とは違う意味を持ち,数値も1桁以上差がある。
融解熱と融点,気化熱と沸点の間にはかなりよい相関がある。
融解熱は,1A族が2〜3,他の典型金属が<10,遷移金属が,<20kJmol-1で,30 kJmol-1を超えるものはほとんどない。
気化熱は小さいものでも70,大きいものは800 kJmol-1を超える。
図7-3には長周期元素の金属結合エネルギーを示した。
この縦軸は気化熱と融解熱の和に比熱の補正を施した値である。
これには次のような特色が認められる。
豗)典型元素より遷移元素の方が結合が強い。
d電子が強固な結合に寄与しているためである。
豩)同一亜族において,原子番号とともに典型元素では結合エネルギーは減少するが,遷移元素では増加する。
(融点・融解熱・沸点もこれに平行している。)
豭)カリウムとカルシウムは異常値を示す。
豳)遷移元素では5A・6A族に極大がある。
d軌道がほぼ半分満ちた電子配置に関係がある。
マンガンの異常値は特殊な結晶構造に原因がある。
ランタノイド元素のデータは正確度が低いが,4f7,4f14配置を持つユーロピウム(63番)とイッテルビウム(70番)が異常に低い値を持つほかあまり顕著な規則性はみられず,ランタンとハフニウムの間くらいの値をとる。(p.211)
2B族の元素を典型元素と見るか遷移元素とみるかは議論がある。
結合エネルギーと原子番号の関係をみると他の典型元素と同様な傾向がある。
d電子が結合に関与しないということと関連し,典型元素とみるべきだという議論の有力根拠となっている。
(2)密度
原子の質量は原子核が担っているが,原子の占める体積は電子状態を反映しており,結合状態と関係が深い。
図7-2に示した密度のデータには次のような傾向が認められ,前述の金属結合エネルギーとの関係が著しい。
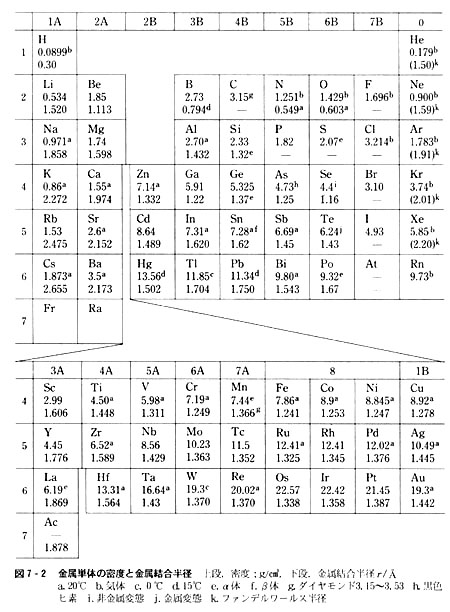
豗)同一亜族では原子番号の増加とともに増加する。
豩)カリウムとカルシウムが異常に低いのは,3dを空軌道にしたまま,4s軌道が満たされるためである。((1),豭)とも関連)
豭)1Aと2A族の値が低く,2B〜4B族典型元素および遷移元素は高い。
アルミニウム(13番),スカンジウム(21番),チタン(22番)が中間である。
豳)同一周期では周期表の右にゆくほど値は増すが,6A〜8および1B族では差が小さく,原子番号の影響のほうが顕著である。
(第5,6周期遷移元素の金属結合半径はほぼ一定であることに注意せよ。)
(3)電流と熱の伝導率
高い導電率は金属の特性の一つで,大部分の金属は比抵抗(5〜10)×10-6Ωcmの値を持つ。
抵抗値は不純物の影響を受けやすい。
銅・銀など1B族が1.6〜2.0×10-6Ωcmと低値が目立ち,ナトリウム,マグネシウム,アルミニウム,カルシウム,チタンなど低密度の金属がこれにつぐ。
遷移元素では第5周期以後の重い金属およびランタノイド金属がやや大きい抵抗値を示す。
しかし原子の電子配置との関係は顕著でない。
典型元素のうちビスマス(約120×10-6Ωcm,結晶の方向により差がある)などの高抵抗は,結晶中を動き得る電子数が少ないためで,半金属と呼ばれる。
金属の電気抵抗は温度上昇とともに増加するのが特色であることは繰り返し述べた。
ある種の金属では絶対零度に近づくと抵抗値が0となる「超電導性」を示す。
この現象については第15回で扱う。
熱伝導率λの高いことも金属の特色の一つで,ほとんどすべての金属は101〜103Wm-1K-1の範囲にある。
マンガン,ビスマス,希土類元素の一部が10 Wm-1K-1以下の値を持つ。
大体において導電率と平行関係にある。
(電流の絶縁体なのに著しく大きい熱伝導を示すダイヤモンド,単体ケイ素,窒化アルミニウムなどは結晶格子の振動として熱を伝えるので,金属の場合とは異なる機構が働いている。)
(4)磁性
金属はほとんどすべて常磁性で,反磁性を示すのは1B〜3B族典型元素の単体だけである(アルミニウムは常磁性)。
分子レベルでは,不対電子の存在が常磁性の原因で,磁化率は温度上昇とともに減少するのが特色である。
金属の磁性は分子集団レベルの性質を反映しており,磁化率の温度依存性も多様である。
1100℃程度までほとんど変化しないもの(モリブデン,タングステン,オスミウム),通常のCurie-Weissの法則に従い融点でも不連続でないもの(カリウム,マグネシウム,亜鉛,インジウム),融点でやや不連続となるもの(ナトリウム,カドミウム),融点付近で不規則な変化をみせるもの(銀,金,タリウム,スズ,鉛)などがあり,電子配置と単純に結び付けることはできないし,簡単な模型で説明することも難しい。(p.209)
(5)仕事関数
金属を加熱したり,電子を放射すると電子が放出される。
(イオン結晶も類似の現象を示す。)
金属結晶から原子1個当り1個の電子を放出させるのに必要なエネルギーを仕事関数という。
この値は単原子から電子を放すのに要するエネルギー―イオン化エネルギー―とは意味が違う。
金属の種類による差は少なく2〜5eVの間に入る。
異方性を持つ結晶では方向により値が異なる。
金属結合の強さ,原子のイオン化エネルギー,表面の状態などにも影響されるので,他の性質との相関は見いだしにくい。
アルカリ金属に低値が目だつのは,結合の弱さおよび1次イオン化エネルギーの低さによる。
この性質を利用してセシウム(1.8eV)は光電池に用いられる。
(6)光学的性質
独特の光沢を持つことも金属の特色の一つである。
どの金属もいわゆる金属光沢を持つけれども,色調は種類によってかなり異なる。
白っぽい光沢を持つアルミニウムや銀は,波長に無関係にどのような可視光でも90〜95%反射してしまう。
後述のように,金属結晶の中には電子(自由電子)がいっぱい詰まっていて,外から入射した光はそれに弾き飛ばされて10-8m程度しか内部に進入できない。
一方,金・銅のように特定波長の光だけを反射するものもある。
金は波長500nm以下の光を吸収し,それ以上の波長の光を反射するので金色にみえ,銅は630nm以下を吸収してそれ以上の光を反射するので赤くみえる。
銀は320nm以下しか吸収せず,可視部の光をすべて反射するので見かけ上白っぽい。
(同じ理由で銀を使った鏡は紫外光の反射には使えない。)
見かけ上白っぽくみえる金属でも,ある波長範囲の紫外光を吸収するものもある。
このような吸収の起こる原因は,金属結晶中の電子状態が完全に自由なわけではなく,いくつかのエネルギー帯に分かれているためである。
入射した光のうち,一つの帯から他の帯へ移るために必要なエネルギーに対応する波長を持つ光は金属結晶内部で吸収されてしまい反射されない。
この波長が金では500nm以下,銅では630nm以下に当る。
また実在の金属では表面にごく薄い酸化物等の膜を生じていて,それがある波長の光を吸収するために着色してみえることもある。
金属結晶がごく細かくなると黒っぽくみえるようになる。
これは入射した光が目に達するまでに何回も反射を繰り返すためである。
1回ごとの吸収率はごく僅かであっても,繰り返しのうちに吸収される分が増し,目に入る光の量が少なくなるからである。
