第9章 イオンの水溶液
イオンの作る化合物[塩類(エンルイ),電解質]が水に溶けると正負イオンに解離し,そのため食塩水などの電解質溶液は電導性をもつ。
イオン結晶を壊してばらばらのイオンにするには1mol当り100〜1000kJものエネルギーを必要とする。(第8回)
これを補うエネルギーは水和から生まれる。
水溶液中でイオンは周りに水分子の結合した「水和イオン」となっているが,その構造を知るにはX線回折法が役立つ。
電解質には溶けやすいものも溶けにくいものもあるが,溶解度を支配する因子はイオン結晶破壊と各イオンの水和に伴うエンタルピーおよびエントロピー変化である。
結晶中のイオンに水分子が近づくと新たな結合が作られ,この結合エネルギーがイオン結晶を壊しイオン水溶液を生じる。
今回は電解質の溶解と,水和したイオンの種々な性質について学習する。
1.イオンの水和
イオンの水和は色々の実験により確認できる。
その構造はイオン導電率の測定やⅩ線回折による動径分布曲線から明らかにされる。
(1)色の変化
塩化コバル卜CoCl2は青色であるが,水に溶かすとピンク色になる。
また濃緑色の塩化銅(Ⅱ)CuCl2は水に溶けて淡青色溶液となる。
このように固体の時と水溶液とで異なる色を示す例は遷移元素化合物に多い。
しかし塩化コバルトの六水和物CoC12・6H2Oは淡紅色の結晶で,水に溶かしてもほとんど色の変化はない。
塩化コバルトの無水物と六水和物の結晶構造は図9-1のようにコバルト(Ⅱ)イオン周りの配列に大きい差がある。
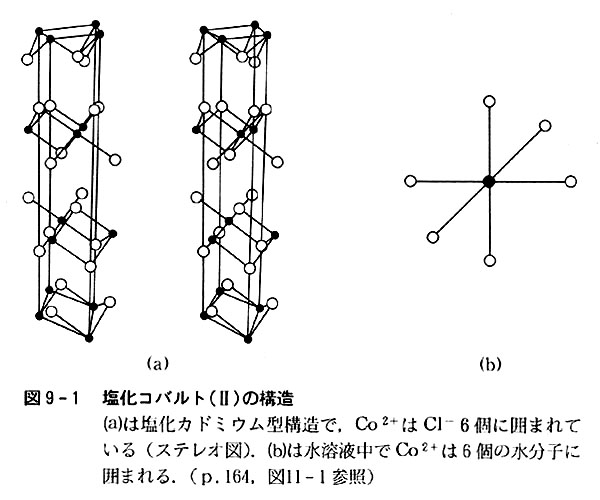
前者では6個の塩化物イオンがCo2+を取り囲んでいるのに,後者では6個の水分子がCo2+の最も近くに位置している。
一般に遷移元素化合物の色は,金属原子(イオン)の周りに位置する分子やイオン(配位子と呼ぶ)の種類・数・配列によってきまるから(p.178),水和イオンを含む結晶と水溶液が同じ色を示すという事実は,水溶液中でもCo2+イオンの周りは水分子によって占められ,[Co(H2O)6]2+のような錯イオンが存在する証拠になる。
(2)イオンの電導とストークス半径
a) モル導電率
電解質溶液が電流を導く時,電荷を担って移動するのはイオンである。
溶液の電気抵抗も金属などの固体導電体と同様,断面積s,長さlの水柱にEVの電位差を与えてiAの電流が流れた時,式(9.1)で定義されるρを比抵抗と呼び,Ωcm単位で示す。
 (9.1)
(9.1)
比抵抗の逆数が導電率で,σで表し,単位はΩ-1であるが,Ωの逆数をシーメンスSで表せばScm-1となる。
電解質溶液の場合は特に電解導電率と呼び,記号κを用いる。
単位はσと同じである。
電解導電率はイオンの濃度にほぼ比例して増加するが,濃度の増加とともに正負イオンの引合いによる導電率の減少も起こるので,厳密には比例せず,κをモル濃度で割ったモル導電率Λ(単位はScm2mol-1)は溶液濃度が低くなるほど増加する。
Λを縦軸に,モル濃度を横軸にプロットしたグラフをモル濃度0に外挿した時のΛ値を無限希釈におけるモル導電率(極限モル導電率Λ∞)と呼び,それぞれの電解質に特有な値となる。
モル導電率に寄与するのは正負イオンであるが,寄与の割合は各イオンの動きやすさ(易動度)により異なる。
各種の塩のΛ測定値を各イオンに割り付けるには種々の手続きが必要であるが,割り付けた値をイオンのモル導電率といいλで示す。
25℃における代表的正負イオンのイオン極限モル導電率λ∞を表9-1に示した。
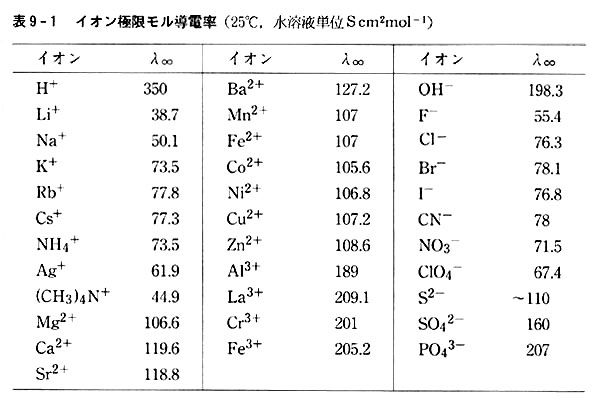
正負イオンともイオン価の影響が大きく,1,2,3価でほぼ1:2:3になるのは予想されたとおりである。
同一イオン価では,イオン半径の大きいイオンが大きいλ∞を持つ。
一見大きいイオンの方が易動度が小さいように思われるが,p.140でみるとおり大きいイオンの方が水和されにくく,ストークス半径が小さくなるためである。
H+およびOH−イオンが著しく大きい値を示すのは,これらが実際に移動することなく,ゴットハウス機構で水素結合の切断・形成によって電荷を運ぶためである。(第4回)
b) ストークス半径
金属の電気伝導と反対に,Λは温度が高いほど大きくなる。
これはイオンの移動が容易になるためである。
その主な原因は温度の高いほど水の粘りけ(粘性率,ηwで示す。
単位は圧力の単位パスカルPaに秒を掛けたPa・s)が減少することにある。
イオンが水分子の間を通り抜けて電極に向かい泳動する時,イオンのサイズが小さいほど動きやすく,イオンの電荷数の高いほど,1個のイオンが運ぶ電気量の多いことも当然で,式(9.2)が成立する。
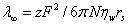 (9.2)
(9.2)
λはイオンモル導電率,zはイオン価の絶対値,Fはファラデー定数,Nはアボガドロ数,rsは溶液中を移動する時のイオン半径(ストークス半径と呼ぶ)である。
純粋な水の粘性率ηwを用いて,イオンモル導電率から算出したストークス半径を縦軸に,同一イオンの結晶中の半径を横軸にとったグラフが図9-2である。
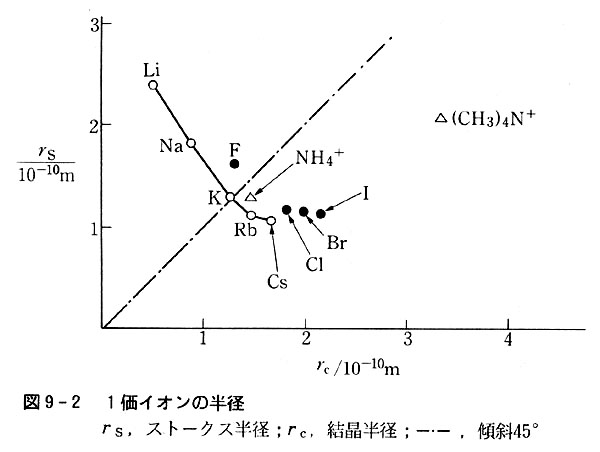
もし結晶中のイオン半径とストークス半径が等しければ,傾斜45度のグラフが得られるはずである。
c) イオンの周り
リチウムイオンのように,ストークス半径が結晶半径より大きい場合は,イオンの周りに水分子が「結合」しており,イオンとともに電極に向かって泳動するため,ストークス半径が大きく観察されると考えれば説明が可能である。
事実,他の多くの証拠からも,アルカリ金属イオンが水溶液中で水和していることは疑いない。
しかしセシウムイオンのように,結晶半径よりストークス半径が小さい時は,式(9.2)に現れる粘性率を再検討する必要がある。
水の粘性率は他の液体に比べて大きいが,それは水が構造をもつためである(p.66)。
一方,陽イオン周りでは水の酸素原子がイオンに近く,陰イオン周りでは水の水素原子がイオンに近づいて,通常の水とは異なった配列を生じている。
水和したイオンの外側(イオンからみて第2層)には,どちらの構造でもない,
ばらばらになった水分子の層が生じていると考えるのが妥当であろう。
その層の粘性率は通常の水よりはかなり小さいはずである。(図9-3)

水和イオンが通り抜けてゆくのは,通常の水の層ではなく,ばらばらになった水分子層である。
式(9.2)で用いたηwは過大な値だったことになり,その結果算出されたストークス半径は過小値である。
図9-2はこのように考えると合理的に説明できる。
(3)水和イオンの構造
イオンの周りに何個の水分子が水和しているかを示す数を水和数という。
遷移元素イオンのように水和エネルギーの大きいイオンの水和数は一定で,また構造を「溶液X線回折計」などを用いて調べることが可能である。
この装置で得られる結果はある原子(イオン)の周りのどの距離に,平均どのような数の原子(イオン)が存在するかというデータである。
これを動径分布曲線という。
結晶中とは違ってイオンや原子の配列は不規則だから,結合角についての情報は得られない。(映像参照)
水和イオンの構造は,結晶水を持つ塩類結晶中における水和イオンの構造と関係が深い。
例えば過塩素酸カドミウム六水和物Cd(ClO4)2・6H2Oの結晶中でCd2+イオンは,周りに6個の水分子が正八面体型に配位した形をとるが,水溶液中の水和Cd2+イオンも同様である。(図9-4)

硫酸銅(Ⅱ)五水和物の中で,銅(Ⅱ)イオンの周りには平面四角形状に4個の水分子が約2.0Åの距離に並んだ形を持つ。
残り1個の水分子は硫酸イオンに結合している。
水溶液中の銅(Ⅱ)イオンは,やはり正四角形に並んだ4個の水分子を2.02Åの距離にもち,四角形面の上下約2.3Å離れて2個の水分子が存在する。
銅(Ⅱ)イオンの配位数は4とも6ともいえる。
これに対し,ナトリウム等のアルカリ金属イオンではイオン周りの水分子数を確定できず,測定方法により異なる結果が得られる。
水和水分子数の異なるNa+イオンが存在するためだと考えられている。

 (9.1)
(9.1)
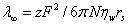 (9.2)
(9.2)

