2.気相における水和実験
(1)イオンビーム実験
イオン水溶液の状態はかなり複雑であって,水分子の間に溶質分子やイオンが単に分散している状態には程遠い。
この点で多くの有機溶媒中の溶液とは著しく異なっている。
(有機溶媒にも水に似た構造を持ち溶質と色々の相互作用をもつものもある。)
イオンの水和に伴うエネルギー変化を明らかにするには,いったん液体の水を離れて,気相でイオンと水分子との相互作用を観察するのが重要な方法である。
これには水素やナトリウムなどのイオンを水蒸気の中に走らせ,水分子と付加したイオンの分子量を質量分析計で測定する。
そのための装置や実験例を映像で見よう。
この実験は技術的にかなり困難で,対象となる系や実験条件には制限があるが,その結果は極めて有用なデータを与えるものである。(p.52をも参照)
(2)水和数の異なるイオンの分布
上記装置の「反応室」ではH+イオンと水分子が反応して,式(9.3)の化学平衡が成立している。

ただし角カッコ内数字は分子量である。
色々な温度・圧力において水和イオンの分子量分布を調べると,異なる数の水
分子を持つ水和水素イオンの分布を示すグラフが描ける
(図9-5)縦軸には水分子数の異なる水和イオンのパーセントを,横軸には圧力を目盛ってある。

圧が高くなると水分子数の多い水和イオンの量が相対的に増加するのは,加圧により単位体積中の水分子数が増すため,式(9.3)の平衡が右方にずれるからである。
温度の高くなった場合は水分子数の少ないイオンが相対的に増えるのは,水和反応が発熱反応であるため,高温では式の平衡が左にずれるためである。
(3)水和エンタルピーと水和エントロピー
温度や圧力を変化させたデータを解析すると,式(9.3)の各段階ごとのエンタルピーおよびエントロピーを算出できる。
アルカリ金属イオンについての水和エントロピーを段階ごとに画いたのが図9-6である。
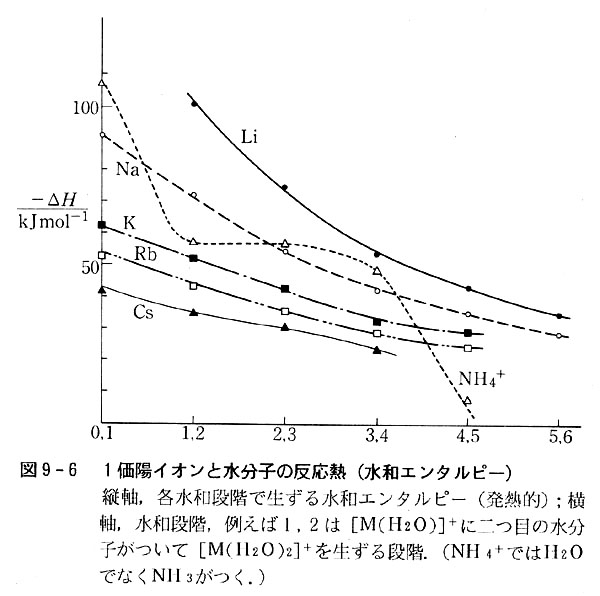
各イオンとも水和数が増加するにつれて,1分子の水和に伴う発熱量は減少している。
同一水和段階についてみると,原子番号の大きいイオンほど水和熱は小さい。
イオンと水分子との相互作用は,陽イオンの正電荷と水分子の双極子モーメントとの間の静電的な力によるので,イオンの電荷密度の大小が親和力の大小を支配すると考えるとこの結果が説明できる。
同一イオンの水和エンタルピーが水和数の増加に伴って減少するのも同様の考えで理解できる。
(イオンに水和した水分子の運動の自由度は減少するので水和エントロピーは負の値をもつ。)
これに対し,水素イオンをアンモニア中に走らせて同様な実験を行うと,NH+イオンの周りに水分子4個が結合したイオン[NH4(NH3)4]+までは結合エネルギーが大きいが,それ以上アンモニア分子のつくときに放出されるエネルギーはかなり小さくなることが分かる。
5個目からは直接H+に結合しないからである。


