3.電解質の溶解と溶解熱
塩類には水に溶けやすいものも難溶性のものもあり,溶解に伴い熱を放出するものも吸収するものもある。
溶解度を支配するエネルギーの出入りを調べよう。
(1)溶解の過程とエンタルピー変化
イオンからなる電解質が溶けてゆく過程は次のように分けて考える。
(これはサイクルとしての模型的な考え方である。実際の進行についてはp.147参照。)
ただしここでは1価のイオンどうしからなる例を示した。

各段階ごとの変化の内容とそれに伴うエネルギー変化は次のように理解される。
第1段はイオン結晶が壊れてばらばらのイオンになる過程であり,その時格子エネルギー(ΔHU)に相当するエンタルピーが吸収される。
第2段は正負イオンを水の中に入れた時イオンが水和される過程にあたる。
このときは両イオンの水和エンタルピー(ΔH+,ΔH−,水和熱ともいう)が放出される。
(2)溶解熱
色々の塩類を水に溶かした時,溶液の温度が上昇する時と下降する時がある。
硫酸,水酸化ナトリウム,塩化カルシウムなどは前者の,硝酸カリウム,硫酸アンモニウムなどは後者の例である。
溶解熱(ΔHS)は式9.3〜9.5各段階のエンタルピーの代数的和に相当する。
(溶解熱の正負と溶解度の大小とは直接関連しない。)
 (9.7)
(9.7)
つまり水和熱として放出される熱より,格子エネルギーが大きい時は吸熱的で,溶解に伴って温度が下がり,逆の時は発熱的で溶液の温度は高くなる。
溶解が吸熱的の場合は温度の高い時の方が溶解度が大となり,発熱的の場合は温度の低い時の方が溶解度が大となるのは,ル・シャトリエの原理から推定されるとおりである。
溶解熱は正確に実測できるし,格子エネルギーも前回で述べたようにして求められるから,正負イオンの水和熱の合計は正確に算出可能である。
しかし,それを正・負イオンに割り付けるのは容易でなく,その方法は省略する。
実測値に基づき合理的に割り付けて求めた水和エンタルピー(水和熱)のデータを表9-2に示した。
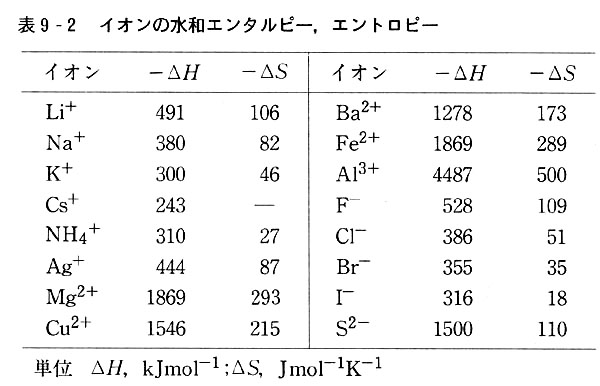
陽イオンについては,イオン価の高いほど,同一イオン価ならばイオン半径の小さいほど,水和エンタルピーは大きい。
陰イオンについても同様な傾向がある。
一方,イオン価の高いイオンからなる結晶ほど格子エネルギーは大きいから,そのバランスによって溶解熱は正または負になる。
(図9-5のようなグラフの各ΔH+の値の総計と,溶解熱から求めた表9-2の
ΔH+が一致しないのは,後者にはイオンの水和に際し,水の構造を壊すのに必要なエネルギーが加わっているからである。)
(3)溶解に伴うエントロピー変化
式(9.4)の変化に伴ってエントロピーは増加するが,式(9.5),(9.6)に際しては減少する.
結晶格子がばらばらになればイオンの運動自由度は増すが,水和が起これば自由度が減少するからである.
前者に伴うエン卜口ピー増加はイオン価の組み合わせによりほぼ一定デ+ 1 〜‐1,および+2〜 ‐1または+1 〜 ‐2の場合,それぞれ170〜190および260〜290Jmol-1 lK-1程度の値となる.
水相エントロピーの正確な求め方の説明は略するが,得られたデータは表9-2に加えてある.
水和エントロピーの絶対値についても,エンタルピーについてと同様な説明が可能である.
水和の程度が強いほど運動自由度が減少する程度もまた増すからである.
(4)溶解度を支配する因子
エンタルピー・エントロピー両者の寄与を考慮した次式のΔGをギブス(自由)エネルギーという.
圧カー定の系においては,絶対温度Tにおいて化学変化はΔG°の減少する方向に進行する(詳細は基礎科目「物質とエネルギー」参照).
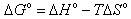 (9.8)
(9.8)
(肩付きOはl mol当りの値であることを示す)
電解質の溶解に伴うギブス自由エネルギーの変化は,式(9.4)〜(9.6)の各段階に対応するエンタルピーおよびエントロピー変化の代数的和として式(9.9)で示される.
 (9.9)
(9.9)
一方,電解質の溶解平衡とそれに伴うギブス自由エネルギーとの関係は式(9.10)で表される。
 (9.10)
(9.10)
ただしRは気体定数,Tは絶対温度,Lは式(9.11)で定義される溶解度積と呼ばれる量である。
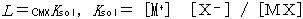 (9.11)
(9.11)
角カッコで示した量はそれぞれ飽和溶液中の陽イオン,陰イオンおよび電離していない塩の濃度で,Ksolは電離の平衡定数である。
Lが大きいほど溶解度は大であり,それは溶解に伴うギブス自由エネルギー値の減少が著しいほど大きい。
(5)塩類の溶解度にみられる一般的傾向
式(9.9)から分かるようにΔGsはエンタルピーとエントロピーのバランスできまるが,最も影響の大きいのは格子エネルギーである。
イオン価の高いイオンの作る塩ほどΔHU値は大きいが,そのような塩は溶解度の低いものが多く,水に溶けやすい塩は1価のイオンからなるアルカリ金属塩や,多価陽イオンのハロゲン化物が多い。
陰イオンの側からみて,ほとんど例外なく溶解度の高いのは,硝酸塩,酢酸塩,ハロゲン化物(例外は銀およびタリウム(I)の塩),過塩素酸塩(例外はカリウム,ルビジウム,セシウム塩)など,1価陰イオンからなる電解質である.
また硫酸塩(例外はアルカリ土金属および鉛の塩)も溶解度の高い塩を多く生ずる.
特別な例として,ハロゲン化アルカリで水に難溶なフッ化リチウムのように,イオン半径が極めて小さいためイオンの水和に伴うエントロピー減少の寄与が大きいものもある.
これに対し,炭酸塩,リン酸塩,ケイ酸塩などの多価陰イオンの塩,クロム酸塩,モリブデン酸塩,夕ングステン酸塩,過マンガン酸塩など,金属元素を含む陰イオンの塩はアルカリ金属塩を除いて大部分は水に不溶である。
また硫化物はアルカリ金属塩,アルカリ土金属塩以外は水に不溶であるため,化学分折の目的でこれら以外の金属イオンを分離するのに用いられる.(p.158)

 (9.7)
(9.7)
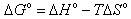 (9.8)
(9.8) (9.9)
(9.9)
 (9.10)
(9.10)
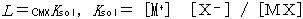 (9.11)
(9.11)