12 化学反応のしくみ(2)
化学反応のメカニズムにはいろいろな形式がある.
前章で学んだ基本的な化学反応がいくつも組み合わさって反応が進行する.
燃焼反応はその代表的なものである.化学反応がどのような反応形式で進むのかをこの章で学ぶ.
1.素反応と複合反応
原子分子の衝突によって起こる反応を素反応という.
より厳密にいうと,1回の衝突による反応確率は,11章で定義した反応衝突断面積である.
原子分子の衝突条件はさまざまであるが,それをある温度での統計平均をとった場合の反応を素反応という.
表11-1の反応は素反応である.ほとんどすべての化学反応は,素反応の組み合わせである.
それを複合反応という.
「化学反応がどのような素反応の組み合わせから成るか」という課題は,反応機構を探るという意味で反応研究の重要な対象である.
複合反応の例として燃焼を考えてみる.
燃焼の基本は酸化反応であるが,燃料と空気の混合気体への着火は,反応を推進する原子やラジカル(不対電子をもつ分子)を発生させる操作である.
原子やラジカルは,その反応の活性化エネルギーが小さいため反応活性に富み,次に説明する連鎖反応を引き起こす.
水素と臭素の反応速度は,単純な2分子反応の形式で書けない.
実験的に求められた反応速度は,
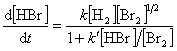 (12.1)
(12.1)
という各成分の濃度の関数となっている.
なぜ,
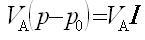 (12.2)
(12.2)
のような単純な形式にならないかは,この反応が次のような連鎖反応の機構をとるからである.
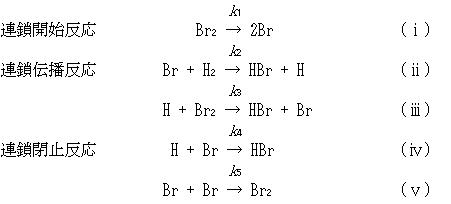
ここで,(ⅳ)と(ⅴ)の反応は第3体の衝突を必要とする3分子反応であるが,2分子反応の形式で記述した.
連鎖開始反応で,一旦Br原子が生成すると,これが反応(ⅱ)と(ⅲ)を繰り返して効率よくHBrを生成する.
Br原子やH原子は,自らを再生しながら反応を進行させるので,これを連鎖担体という.
連鎖担体の寿命は,反応(ⅳ)や(ⅴ)の再結合反応で定まる.連鎖担体を生成する反応の速度をγi,閉止する反応のそれをγb[R]2とすると,連鎖担体の定常濃度は,生成と消滅の反応のバランスとなっているから
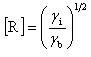 (12.3)
(12.3)
となる.
反応全体の進行は,伝播反応の速度γPで定まるから,
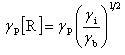 (12.4)
(12.4)
の速度で反応生成物が生成することになる.
連鎖反応は,開始反応の速度が大きく,閉止反応の速度が小さい場合に反応は効率よく進むことになる.
均一気相反応の閉止反応は連鎖担体の原子ラジカルの再結合反応で,3分子反応である.
したがって,圧力の低い場合には,その速度γbは小さい.
つまり,担体の寿命は長い.高層大気中のオゾンがフロンガスから光化学反応で生じた塩素原子で破壊されるのは,連鎖反応の機構である.
この他,連鎖反応は,燃焼,炭化水素の熱分解,重合反応など,いろいろな場合に起こる重要な反応である.
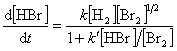 (12.1)
(12.1)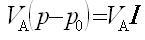 (12.2)
(12.2)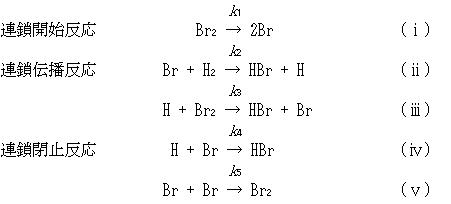
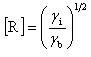 (12.3)
(12.3)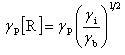 (12.4)
(12.4)