2.溶液中の化学反応
溶液中の化学反応速度は気体中のそれと異なるであろうか.
液体を単に極めて圧力の高い気体と見なすことができれば,溶液反応も気相反応と本質的に同じになる.
しかし,液体の中での分子の移動は,気体中ほど自由ではない.すなわち,反応分子の移動は分子の拡散運動によって支配されている.
溶液反応は気相のそれと基本的に違う特徴をもつ.
それは,気相では起こらない反応が可能になることである.
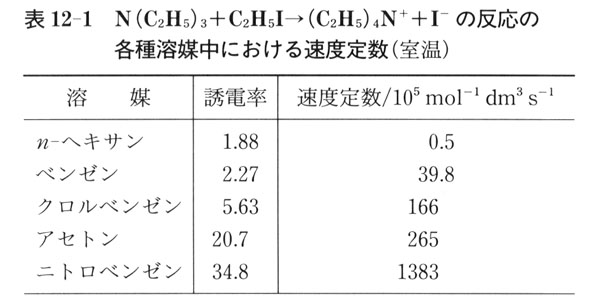
誘電率の大きい溶媒によって溶質分子に対して大きな分極作用が及ぶ.つまり,極性溶媒中では,双極子モーメントをもつ分子は安定化する.
たとえば,次の電荷移行反応
N(C2H5)3 + C2H5I → (C2H5)4N+ + I- (12.5)
では,遷移中間体として
が考えられる.
この中間体は極性溶媒中で安定化する.
つまり,反応の活性化エネルギーの低下によって反応速度が大きくなる.表12-1に溶媒の誘電率と速度定数との関係を示す.
気相中でイオンが存在できるのは,プラズマのような高エネルギー気体の中である.
これに対し,水を初めとして誘電率の大きい溶媒中ではイオンが安定に存在できる.
イオン反応が起こるのは,極性溶媒(とくに水)の溶液の重要な特徴である.
