3.燃焼
「ものが燃える」現象は,「物質の酸化反応が高速に自己維持される」状態を意味する.
自己維持とは,燃料と酸化剤(たとえば空気)のシステムがいったん発火したとき,燃焼反応が継続して起こることを指す.
図12-1のブンゼンバーナーの火炎では,燃焼は円錐形の火炎面に対して垂直方向に上から下へ,未燃気体へ向かって進行する.
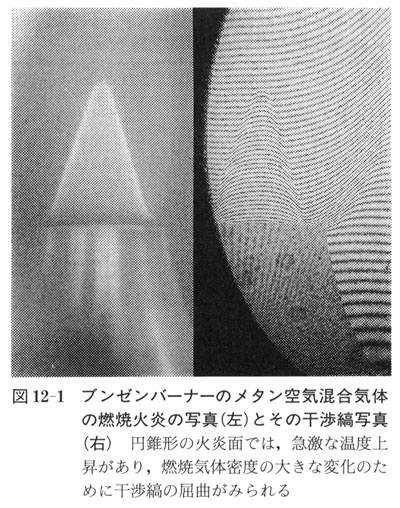
火炎面が動かないのは,未燃気体の流れの火炎面に対する垂直方向の成分が燃焼速度と等しいからである.
燃焼速度が小さいときには,火炎面の頂角が小さくなる.
したがって,測定した頂角と未燃焼気体の流速とから燃焼速度が決定できる.
それは,燃料の種類,空気の比率によって変わるが,1 ms-1内外である.
火炎面の厚さは,図12-1のような密度変化の測定によると0.1 mm程度である.
このことは,室温の未燃焼気体から2000K位の高温の燃焼気体への化学変化が10-4s程度の時間で終了することを意味する.
燃焼のような高速反応が起こる機構は,1930年代初めにセミョーノフ(N.N.Semenov)とヒンシェルウッド(C.N.Hinshelwood)が独立に提案した連鎖分岐の考え方で明かにされた.
1節で説明した連鎖反応では,連鎖担体によって伝播反応が一定の速度で進行する.これに対し,連鎖分岐反応,たとえば,燃焼反応では
H + O2 → OH + O (12.6)
O + H2 → OH + H (12.7)
の反応で,連鎖担体のO,H,OHをネズミ算的に増やすことができる.
その結果,反応は爆発的に進行することになる.
いま,連鎖担体が開始反応によって月の速度で生成し,連鎖分岐を含む伝播反応で (α - 1)γb[R] の速度で増加するとする.
αは分岐反応で生成する連鎖担体の分子数である.
したがって,担体は1回の反応で(α - 1)個だけ増える.
いま,担体が連鎖閉止反応でγb[R]の速度で消滅すると仮定する.
すると,連鎖担体の濃度の時間変化は,
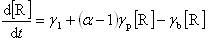 (12.8)
(12.8)
となる.
定常の条件では,(12.8)式は0であるから
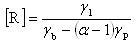 (12.9)
(12.9)
である.
ここで,α = 1の場合が連鎖反応に相当する.
反応(12.6)や(12.7)のような連鎖分岐反応の寄与がある場合には,α > 1である.
すると条件によっては,(12.9)式の分母が0となることもある.
すると,連鎖担体の濃度は無限大となる.
そのときの反応は爆発的に進行する.
セミョーノフやヒンシェルウッドは,爆発の条件の研究から連鎖分岐の考えに到達した.
燃焼は定常反応であって,爆発ではないが,やはり(12.6)や(12.7)の連鎖分岐反応が基本的役割を果たしている.
発電所ボイラーや自動車排気ガスには,酸化窒素,二酸化窒素(これらをNOXと総称)が含まれている.
燃焼ガス中での酸化窒素の生成は,空気中の窒素の酸化反応で
O + N2 → NO + N (12.10)
N + O2 → NO + O (12.11)
の機構によるといわれている.
反応(12.10)の活性化エネルギーは315 kJmol-1で,大変大きい.
したがって,酸化窒素の生成は高温燃焼でより顕著になる.
つまり,燃焼効率を高めようとすると,排ガス中のNOXの割合がより増えるという厄介な問題が起こる.

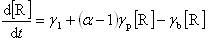 (12.8)
(12.8)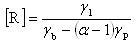 (12.9)
(12.9)