4.酵素反応
酵素は生体内のいろいろな化学反応を円滑に進行させるための触媒である.
それは特定の反応だけに対して触媒作用を示すという反応特異性の他に,反応物質として特定構造をもつ分子から成る物質(これを基質という)を選択するという基質特異性を示す.
この基質特異性は,反応に先立って酵素の活性部位に基質が非共有結合で錯体を作るために生ずる.
この錯体では,反応の活性化エネルギーが著しく低く,生体の温度で十分速く反応を進行させる.
酵素と基質の特異な相互作用は,酵素を構成するタンパク質の特定の構造によってもたらされる.
さらに,生体にとって都合のよい反応制御を行うために,複数のタンパク質で酵素が構成されることがある.
これらの酵素では,複数のタンパク分子の間の結合状態によって酵素機能を制御できる.
それによって,生体内の物質代謝やエネルギー代謝が定常的に維持される.

●酵素の選択性
酵素の大部分はタンパク分子から構成されているが,酵素分子の表面に基質を結合できるポケット,すなわち,基質結合部位がある.図12-2に模型的に示すように,このポケットの形にちょうど適合する物質だけが結合できる.
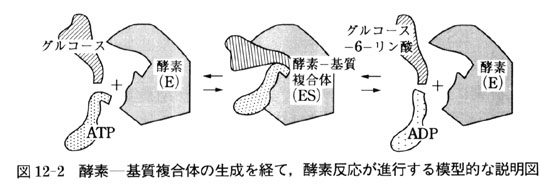
このことによって酵素は特定の基質のみを選択することができる.
結合部位には,酵素の活性中心が存在し,そこには,イオン性,求核性,その他の反応性基が適切に配置されている.
したがって,酵素と基質が結合した形で特定の反応が進行する.
酵素の基質選択性を示すもっとも顕著な例は,光学異性体の選択である.たとえば,L体に対してのみ作用する酵素が存在する.
すなわち,L-アミノ酸オキシダーゼは,
L-アミノ酸 + O2 → 2-オキソ酸 + NH3 + H2O2 (12.12)
の反応を推進し,D-アミノ酸に対しては作用しない.
その理由は,酵素の活性部位に対して,光学異性体の基質と少なくとも3点で結合するからである.
その結果,鏡像異性の構造を判別することができる.
基質を正確に認識するために,微妙な形をした活性部位が必要なために酵素は大分子に進化したと考えられる.
大きい分子の酵素と基質とのはめ合いが,きっちりする.また,反応をよく進めるための水を遠ざけた環境もつくれる.
酵素作用を調節する他の分子との接合も酵素分子が大きい方が有利である.
つまり,酵素とは反応の遷移中間体がはまり込む構造をもつ分子である.
●酵素反応の速度
酵素(E)は基質(S)と錯合体(ES)を経て生成物(P)を生成する.すなわち,その反応式は次のようになる.
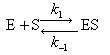 (12.13)
(12.13)
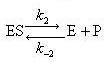 (12.14)
(12.14)
普通,酵素に対して基質は大過剰で,生成物の初期濃度は零である.
したがって,反応(12.14)で逆反応は無視できる.
錯合体の濃度について定常状態を仮定すると,
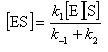 (12.15)
(12.15)
ここで,平衡定数
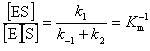 (12.16)
(12.16)
を定義し,Kmを酵素反応の速度論的研究を初めて行ったミカエリス(L.Michaelis)の名をとって,ミカエリス定数という.
酵素の初期濃度を属とすると,[E] = E0 - [ES]であるから,
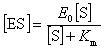 (12.17)
(12.17)
となる.
したがって,反応の初期速度は
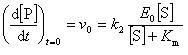 (12.18)
(12.18)
である.
これをミカエリス-メンテン(Menten)の式という.
基質が大過剰であれば,反応液中の酵素のすべてがESとなっている.
すなわち,[ES] ≒ E0である.
このときの反応速度は最大で
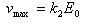 (12.19)
(12.19)
となる.
(12.18)式を書き換えると,
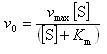 (12.20)
(12.20)
となる.
酵素反応の初期速度は,図12-3のように[S]の増加とともに大きくなり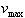 へ近付く.
へ近付く.
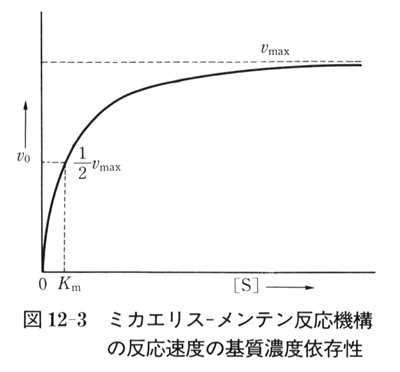
[S] = Kmのとき,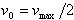 で,最大反応速度の1/2である.
で,最大反応速度の1/2である.
[S] << Kmの場合には,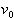 は[S]に対して1次であるが,[S]が大きくなると,
は[S]に対して1次であるが,[S]が大きくなると,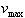 に近付き,[S]について0次となる.
に近付き,[S]について0次となる.
Kmの値は,ふつう10-2〜10-7moldm-3程度である.
(12.19)式より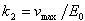 で,それは,酵素1モル当り単位時間に生成物へ変化する基質のモル数である.
で,それは,酵素1モル当り単位時間に生成物へ変化する基質のモル数である.
尽を酵素の回転数という.
酵素の回転数はおよそ1×104 s-1内外である.
生体系は多用な酵素によって支えられている.
そのためには,上記の基本的な反応機構に加えて,反応制御のために極めて巧妙な仕組みが用意されている.


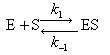 (12.13)
(12.13)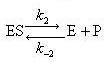 (12.14)
(12.14)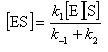 (12.15)
(12.15)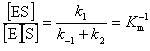 (12.16)
(12.16)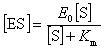 (12.17)
(12.17)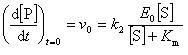 (12.18)
(12.18)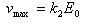 (12.19)
(12.19)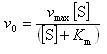 (12.20)
(12.20)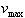 へ近付く.
へ近付く.
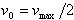 で,最大反応速度の1/2である.
で,最大反応速度の1/2である.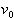 は[S]に対して1次であるが,[S]が大きくなると,
は[S]に対して1次であるが,[S]が大きくなると,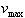 に近付き,[S]について0次となる.
に近付き,[S]について0次となる.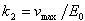 で,それは,酵素1モル当り単位時間に生成物へ変化する基質のモル数である.
で,それは,酵素1モル当り単位時間に生成物へ変化する基質のモル数である.