14 エネルギー変換の化学
生命の営みも,快適な暮らしも,車や新幹線の動きも,根元には化学変化がある.
そのとき,物質に秘められていた化学エネルギーが,力学・熱・電気・光などのエネルギーに姿を変える.
逆に,電気や光のエネルギーを物質の化学エネルギーに変え(て蓄え)る道もある.
本章では,こうしたエネルギーの変換を化学の目で眺める.
1.いろいろなエネルギー
●エネルギーの相互変換
エネルギーのおもな形態には,核(核分裂・核融合),熱,化学,光,力学,電気の六つがある.
互いに移り変わるありさまと,それぞれに関係した現象・装置などの名前を図14-1に描いた.
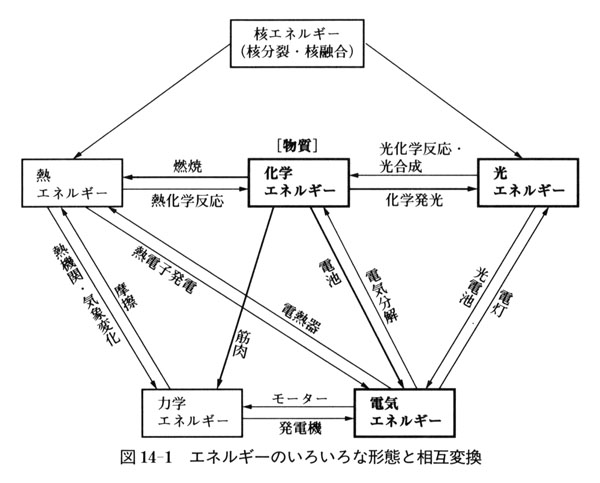
蛍光灯の光を考えよう.まず太陽の核(融合)エネルギーが光エネルギーに変わり,それが太古の植物の光合成で物質の化学エネルギーになり,植物を食べた動物体(物質)の化学エネルギーにもなった.
その遺物(化石資源)を人間が燃やして熱エネルギーにし,火力発電タービンの力学エネルギーを経て電気エネルギーに変え,再び光エネルギーに戻したのが,蛍光灯の光にほかならない.
余談ながら,今の話でもわかるように,私たちがつかうエネルギーは,原子力・地熱・潮汐を除き,すべてが太陽に源をもつ.
気象や海流も太陽の熱エネルギーが生む.
人間の手と英知が生んだかに見える高度産業社会も,じつはことごとく太陽の恵み──という視点は,地球環境と未来社会を考えるときに欠かせない.
●標準生成ギブズエネルギー
物質には安定なものと不安定なものがあり,それが化学変化を促す.
ある物質がどれほど不安定か──それをぴたりと語るのが,第5章で紹介したように,物質それぞれの標準生成ギブズエネルギー にほかならない.
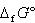 の値を図14-2にいくつか例示した.
の値を図14-2にいくつか例示した.
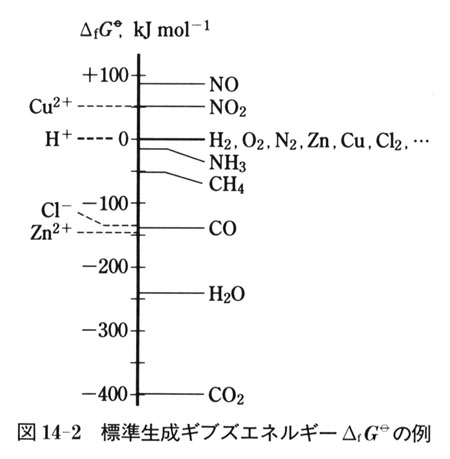
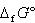 は,電荷をもたない物質については,常温常圧でいちばん安定な単体の値をすべて横並びに0と約束して表す.
は,電荷をもたない物質については,常温常圧でいちばん安定な単体の値をすべて横並びに0と約束して表す.
また水中のイオン種については,水素イオンH+の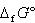 を0とした相対値で表す.
を0とした相対値で表す.
図14-2の中では,縦軸の値が正で大きい物質ほど相対的に不安定,負で絶対値の大きい物質ほど相対的に安定,といえる.
化学変化はギブズエネルギーの減る向きに進むから,この図だけでも,たとえば以下はみな自発的に進みうる反応だとわかる(確かめよう).
こうした反応が進めば,エネルギーが何かの形で外に出てくる.
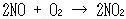 (14.1)
(14.1)
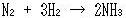 (14.2)
(14.2)
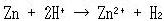 (14.3)
(14.3)
いっぽう,次の反応は自然には進まない(これも確かめよう).
進めるには,外から何かの形でエネルギーを加える必要がある.
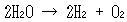 (14.4)
(14.4)
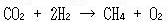 (14.5)
(14.5)
ギブズエネルギーは「仕事」と等価だから,電気や光のエネルギーとそのまま換算できる(高校化学の「反応熱 = エンタルピー変化」では,それができない).
この重要な事実が,化学エネルギー変換を定量的に扱う際の基礎になる.
●電気エネルギー
化学エネルギーと電気エネルギーの間の変換を考えるとき,いつも頭に置いておくべき関係がある.
電気エネルギーをジュール( J )単位,電荷をクーロン( C )単位,電圧(電位差)をボルト( V )単位で表したとき,次の関係式が成り立つ.
エネルギー( J ) = 電荷( C ) × 電圧( V ) (14.6)

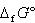 の値を図14-2にいくつか例示した.
の値を図14-2にいくつか例示した.
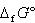 は,電荷をもたない物質については,常温常圧でいちばん安定な単体の値をすべて横並びに0と約束して表す.
は,電荷をもたない物質については,常温常圧でいちばん安定な単体の値をすべて横並びに0と約束して表す.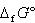 を0とした相対値で表す.
を0とした相対値で表す.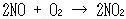 (14.1)
(14.1)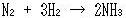 (14.2)
(14.2)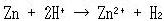 (14.3)
(14.3)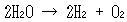 (14.4)
(14.4)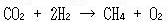 (14.5)
(14.5)