2.電池
●電地反応と起電力
すでに第5章でも学んだ銅-亜鉛電池(日本での通称ダニエル電池.)を復習しよう.
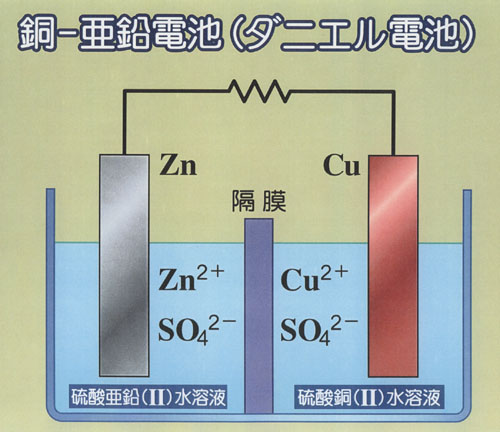
あらためて,向きも起電力も未知とし,ギブズエネルギーをもとに考える.
まず,電子授受する物質の対をとりあえず等号で結んで,次のように書く.
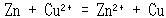 (14.7)
(14.7)
各物質の標準生成ギブズエネルギー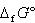 をデータ集で当たると,単体のZnとCuは約束により0,Cu2+は +65.49 kJmol-1,Zn2+は -147.06 kJmol-1.
をデータ集で当たると,単体のZnとCuは約束により0,Cu2+は +65.49 kJmol-1,Zn2+は -147.06 kJmol-1.
だから,式(14.7)は右向きに進むとわかる.
次に起電力を式(14.6)で計算する.
1モルのZnあたり,右向き反応のギブズエネルギー減少分はJ単位で212550Jとなり,このとき動く電子2モルの電荷はファラデー定数(96485 C mol-1)の2倍だから,
212550 J = 2×96485 C × 電圧 (14.8)
が成り立ち,割り算で,電圧 = 1.1014・・・・ V(約1.10 V)を得る.
●電池の分極(電解の過電圧)
現実の電池では,起電力は必ずしも計算どおりにはならない.
とくに,電流値が上がると電圧は下がってくる.
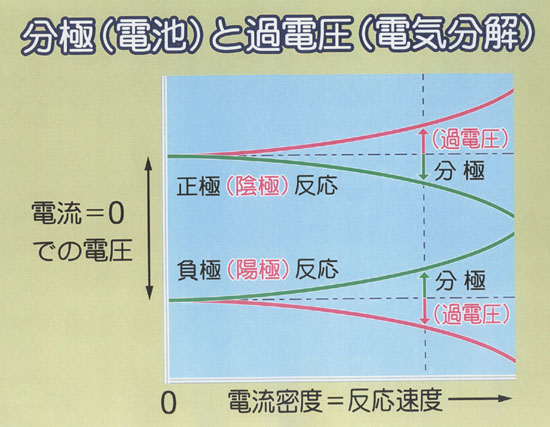
電流は,その単位(A = Cs-1)からわかるように反応速度の一種である.
一般に,反応の勢いを上げるには余分なエネルギーがいる.
電池のような反応系では,式(14.6)が語るようにエネルギーは電圧と等価だから,外にとり出せる電圧がその分だけ下がる.
こうした電圧の低下分を,電池の分極(polarization)という.
なお,電池の裏返しに当たる電解(電気分解)でも,同じ原因により,計算値より大きい電圧が必要になる.
このずれを過電圧(overvoltage)と呼ぶ.
●燃料電池
水素H2の燃焼(酸素O2との反応)も自発変化のひとつである.
H2の出した電子をO2が受けとる反応だから,電子のやりとりを別々の電極でさせれば電池ができる.
このような,燃料になる物質をつかってつくる電池を燃料電池という.
起電力を計算してみよう.反応は次のように書ける.
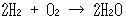 (14.9)
(14.9)
水H2Oの標準生成ギブズエネルギー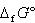 は-237.13 kJmol-1で,上式の酸素1モルあたりではその2倍だから,反応のギブズエネルギー減少分( J単位)は474260 Jとなる.
は-237.13 kJmol-1で,上式の酸素1モルあたりではその2倍だから,反応のギブズエネルギー減少分( J単位)は474260 Jとなる.
このとき動く電子は4モル,その電荷はファラデー定数の4倍なので,次式が成り立ち,
474260 J = 4×96485 C × 電圧 (14.10)
割り算すると電圧 = 1.2288・・・・ V(約1.23 V)が得られる.
反応(14.9)は,いろいろな結合の切断や形成を含み,銅-亜鉛電池に比べてずっと複雑なだけに,過電圧も大きい.
そのため,現実に電池を組むと電圧(起電力)は0.9〜0.7 Vあたりまで落ちてしまう.
しかし燃料電池は,燃料をそのまま燃やす火力発電に比べると効率が高く,未来のエネルギー源(商用電力,電気自動車など)としてさかんに研究開発が行われている.

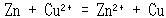 (14.7)
(14.7)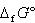 をデータ集で当たると,単体のZnとCuは約束により0,Cu2+は +65.49 kJmol-1,Zn2+は -147.06 kJmol-1.
をデータ集で当たると,単体のZnとCuは約束により0,Cu2+は +65.49 kJmol-1,Zn2+は -147.06 kJmol-1.
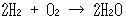 (14.9)
(14.9)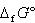 は-237.13 kJmol-1で,上式の酸素1モルあたりではその2倍だから,反応のギブズエネルギー減少分( J単位)は474260 Jとなる.
は-237.13 kJmol-1で,上式の酸素1モルあたりではその2倍だから,反応のギブズエネルギー減少分( J単位)は474260 Jとなる.