3.電気分解
●電気分解の理解
わが国の中学と高校では,戦後すぐから半世紀以上,電気分解を図14-3のイメージで教えてきた.
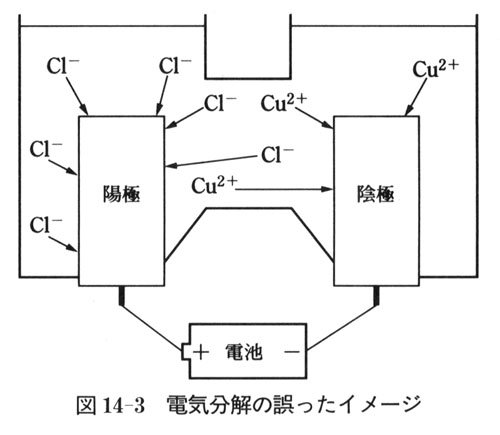
言葉では次のようになる.
電解液に電流を通じると,陽イオンは陰極に,陰イオンは陽極に引かれ,それぞれ電子授受して原子(分子)になる.
けれどもこれはまったくの誤解だった.
まず,「電流」は電解の原因ではなく,電解の結果として流れる.
また,電解の主因は「電荷の引き合い」ではないし,いま知られる電解反応のうち「イオンが反応する」系はごくわずか,おそらく全体の1%未満しかない.
電解は,あくまでも「電気→化学エネルギー変換」として進む.
おなじみの塩化銅(Ⅱ)水溶液の電解についてそれを眺めよう.
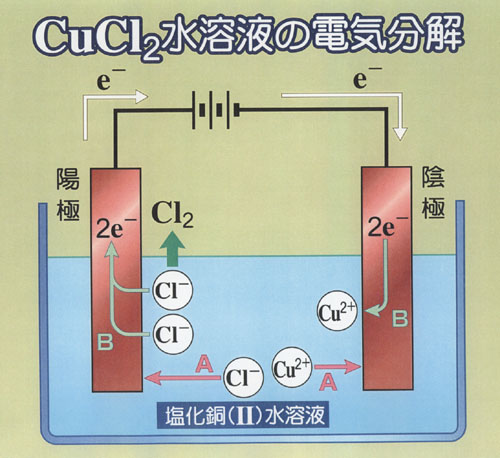
起こす反応は次式で書ける(CuCl2 → Cu + Cl2の「分解」ではない).
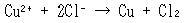 (14.11)
(14.11)
標準生成ギブズエネルギー(Cu2+ : +65.49 kJmol-1,Cl- : -131.23 kJmol-1)より,式(14.11)のギブズエネルギー変化は,銅1モルあたりで +196.97 kJとなる(確かめよう).
すると,式(14.10)と同様な計算から,(14.11)は「約1.02 V以上の電圧をかけて初めて進む化学変化」だとわかる.
反応物がイオンになるのは,偶然の産物にすぎない.
●水の電気分解

白金電極で希硫酸を電解すると,水が分解されて陽極から酸素,陰極から水素が出る.
これも「電気→化学エネルギー変換」なので,一定値以上の電圧をかけなければ(つまり,一定値以上の電気エネルギーを投入しなければ)進まない.
反応は式(14.9)の逆向きだから,式(14.10)の計算がそのまま利用でき,最小の所要電圧は約1.23 Vとなる.
電圧可変の直流電源をつかって,図14-4のような実験をしてみるとよい.
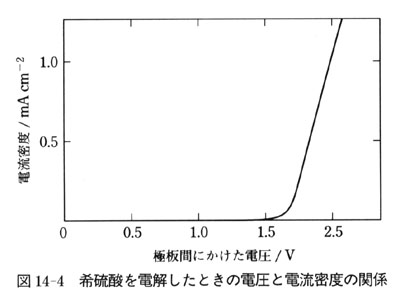
電圧が一定の値を越すまで電流が流れない(したがって,気体も発生しない)事実を目で見れば,「電気→化学エネルギー変換」を実感できるだろう.
●過電圧
ただし理論値の1.23 Vでは何も起こらず,過電圧(とりわけ,酸素発生の過電圧)が大きいため,目に見える勢いの電解を進めるには最低でも2 V,ふつうは3~6 V以上をかける.
白金電極をつかった場合,電圧が2 Vだと,電極の1cm2から出る水素は毎分ほぼ0.01 cm3(かろうじて目に見えるレベル)でしかない.
●二次電池
電解の産物は,電気エネルギーをとりこんだ物質(群)だから,電極のそばにとどめておくと,電解の直後は電池ができる.たとえば食塩水の電解は次式で表され,
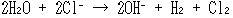 (14.12)
(14.12)
各物質の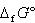 値からはじくと,最小必要電圧は約2.19 Vになる.
値からはじくと,最小必要電圧は約2.19 Vになる.
電解のあとは,(14.12)の逆反応が進む電池になって,起電力は最大で2.19 Vとなるはずだが,生成物が局所的に濃縮されていたりすると,もっと大きな起電力が観測される(濃度の効果については,巻末の参考書を参照のこと).
このように,電解と放電をくり返せる電池を二次電池(蓄電池)という.
現在,パソコンや携帯電話,電気自動車の電源として,リチウム電池やニッケル・水素電池など,さまざまな二次電池が実用化され,あるいは実用化途上にある.
●電気分解の化学反応
かつて高校では,たとえば希硫酸の電解で酸素が出る反応を,
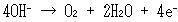 (14.13)
(14.13)
と書いていた.
しかし希硫酸中のOH-の濃度は10-13 moldm-3程度しかない.
電解電流は反応物の濃度に比例し,両者の関係は定量的にわかっていて,たとえば電流密度1 mAcm-2(気体がかろうじて見えるレベル)を流すには,反応物の濃度として約10-2 moldm-3を要する.
そのため式(14.13)が成り立つのはpH > 12のアルカリ性水溶液にかぎられ,それ以外の場合には次式で書かなければいけない.
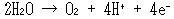 (14.14)
(14.14)
ついでにもうひとつ指摘しておく.平成10年度現在で14冊ある『化学IB』教科書のうち,12冊が次の「法則」を載せている.
電極で反応するイオンの物質量は,その価数に反比例する.
まず,電解反応の大半は「イオンの反応」ではないから,この言明は「法則」の資格をもたない.
それに,イオンが反応する希な例についても誤りだということは,次の2反応を考えればわかる.
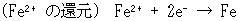 (14.15)
(14.15)
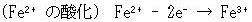 (14.16)
(14.16)
こうした誤りもいずれは教科書から消えていくだろう.


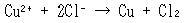 (14.11)
(14.11)

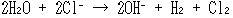 (14.12)
(14.12)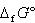 値からはじくと,最小必要電圧は約2.19 Vになる.
値からはじくと,最小必要電圧は約2.19 Vになる.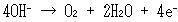 (14.13)
(14.13)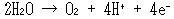 (14.14)
(14.14)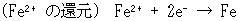 (14.15)
(14.15)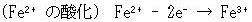 (14.16)
(14.16)