15 触媒の化学
触媒は,化学反応系中に微量存在してそれ自身はあまり変化せずに化学反応の速さや道筋をコントロールする化学物質である.
実際,様々な触媒が物質・材料合成のキーテクノロジーとして,化学産業だけでなく各種産業や生活の中で広く使われている.
1.触媒の機能
15章では,触媒の基本的な機能,その作用機構について応用例をあげながら解説する.
たとえば,図15-1に示すように,身近に使われる材料や燃料の多くは,何段階もの触媒プロセスによって石油,天然ガスなどの原料から作られている.
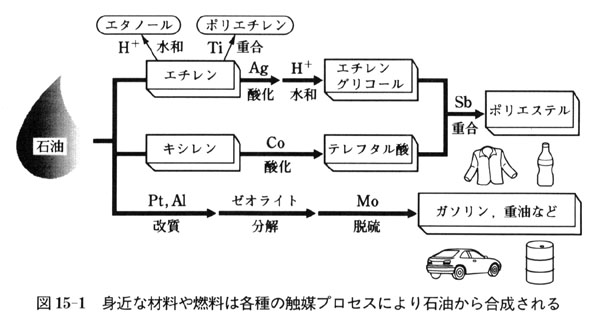
医薬・農薬などのファインケミカルズの合成にも触媒が使われる.
また,自動車や発電所の燃焼排ガスなどに含まれる有害物質を無害化して環境を守る反応にも,さらに廃棄物が少なく環境に優しい合成反応を実現するためにも触媒が主役を演じる.
このように,重要性が増していく触媒の作用を理解するには速度論と平衡論の関係を正しく知る必要がある.
すなわち,触媒は化学反応の速度を変えるが化学反応の平衡は変えないということである.
たとえば,N2とH2の混合ガスを触媒に接触させると(15.1)式に従ってNH3を生成しガス組成が変化していく.
そして,その組成が,(15.2)式の平衡定数KPに達すると組成の変化が止まる.
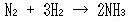 (15.1)
(15.1)
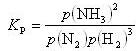 (15.2)
(15.2)
このとき,反応系は平衡にあり,正方向と逆方向の反応速度が一致して見かけ上組成が変化しない.
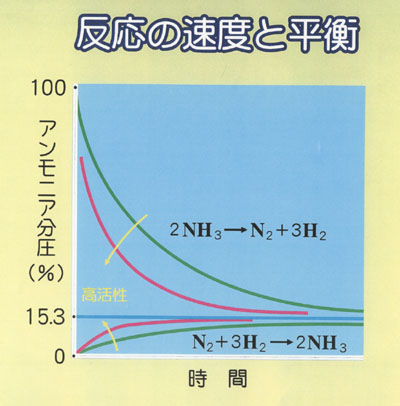
触媒の種類によって平衡に到達する速度は変化するが,最終的に到達する平衡組成は変わらない.
この意味では,触媒は平衡論の制約から逃れられない.
平衡論(熱力学)的に不利な反応を進めるためには,温度,圧力を変えるとか,生成物を反応系から除去するなど平衡をずらす工夫が必要である.
ここでいう平衡論の制約というのは,平衡論的に可能な複数の反応があるとき,平衡論で有利なつまり熱力学的に安定な生成物が常に生成するということではない.
触媒の面白さは,平衡論的には不利であるが有用な反応を選択的に起こさせることにある.
たとえば,エチレンを酸化して,二酸化炭素と水にせずにエチレンオキシドを合成することである((15.3)式).
次に,触媒機能には三つの要素があることを知っておこう.
反応速度を増大する機能を「活性」,反応経路を選ぷ機能を「選択性」,機能を維持できる期間を「寿命」(或いは耐久性)という.
この三つが触媒の基本的機能である(図15-2).
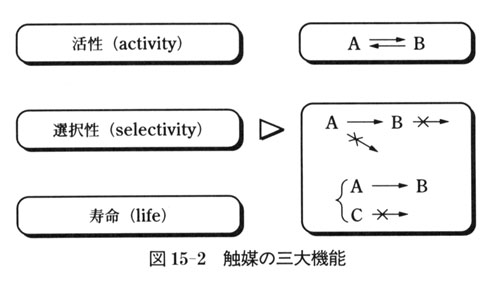
活性は最も基本的な機能で,触媒なしでは起こらない反応が触媒の存在により起こる.
活性が高ければ触媒量が少なく,低温で反応させることもでき,また反応の制御が容易になる.
実際の触媒反応では,流通反応系といって,触媒を充填した反応管の一方(入口)から原料ガスを送入し,他方(出口)から生成物をとりだすことが多い.
流通反応系では単位触媒量,単位時間当りの生成物の収量を空時収率といい,空時収率は触媒性能の目安となる.
選択性とは,可能性のある複数の反応の中から希望する反応を選んで進行させる能力である.
選択性には,一つあるいは一組の反応分子から特定の生成物だけを得る場合の選択性と,混合物から特定の反応分子を選んで反応させる選択性がある.
選択性が100%になると,希望する物質が効率よく得られて資源の節約になるだけでなく,生成物の分離精製が簡略になり省エネルギー効果も大きい.
さらに有害物質の副生が少なくなるので環境に優しくなる.このように選択性の向上は一石三鳥である.
寿命(耐久性)も大事である.
定義では変化しないことになっている触媒も使用しているうちに次第に機能が低下して,取り替えるか再生するかしなければならない.
実用触媒は高価な元素を用いることが多くまた手の込んだ作り方をするので一般に値段が高い.
したがって,寿命が長くなければ実用化されることはない.
実用触媒の寿命はふつう半年から5年である.
触媒機能の低下の原因には,毒物質(不純物,副生物)による被毒,炭素質の析出,活性成分・担体の変質・飛散,機械的・熱的破壊などがある.

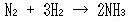 (15.1)
(15.1)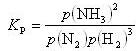 (15.2)
(15.2)
