3.触媒の作用機構と反応速度論
図15-5は,パラジウム金属を触媒として一酸化炭素が酸化して二酸化炭素になる反応のエネルギーにこではエンタルピー)変化を実験結果に基づいて模式的に示したものである.
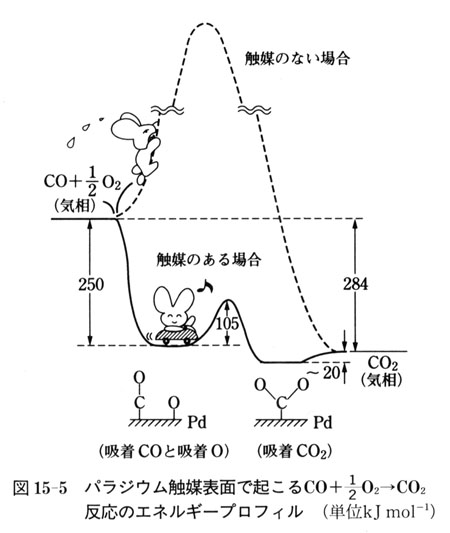
無触媒ではエネルギー障壁が大きいため反応しないものが,パラジウム触媒の表面ではエネルギー障壁の小さい素反応の組合せからなる別のルートが出来て,酸化反応がスムーズに進行する.
この図から触媒作用の重要なポイントを読み取ることができる.
第一のポイントは,約400 kJmol-1の結合エネルギーを持つ酸素一酸素結合を切断する反応がパラジウム表面でほとんどエネルギー障壁なしで起こること,第二は反応が済むと触媒はもとに戻ることである.
そして,第三のポイントは生成した酸素原子の反応性が高いことである.
反応系と生成系のエネルギー差は触媒によらず一定であるから,もし,中間体の酸素原子が表面で安定になり過ぎると後続の反応のエネルギー障壁は必然的に大きくなり低活性となる.
一方,酸素原子の状態が表面で不安定すぎると肝心の酸素原子が生成しにくい.
つまり,中間体(酸素原子)の適度な安定性が必要である.
この第三のポイントは,良い触媒の必要条件であり,触媒探索のための重要な手がかりとなる.
錯体触媒の場合も触媒作用は本質的に同じである.

触媒が分子であるため触媒の分子設計がより容易である.
しかし,錯体触媒は一般に熱安定性が低く温和な条件を必要とする.
反応分子と触媒との結合は,固体触媒では吸着,錯体触媒では配位と呼ぶ.
次に触媒反応の速度について考えてみよう.
触媒反応は図15-5からもわかるように素反応群からなる複合反応系である.
従って,触媒反応の速度式は反応機構により様々に変化する.
簡単な反応機構の速度式を考えてみよう.
気体分子A(g)が,固体触媒表面の活性サイトに吸着してA(a)となった後,吸着した生成物分子B(a)に変換され,気相へB(g)として脱離する反応を考える(図15-6).
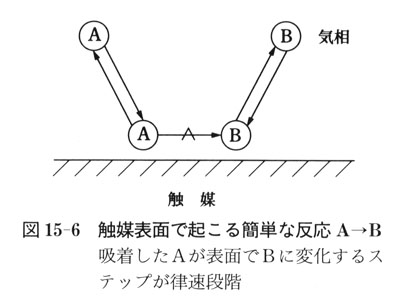
ここで,(g)は気体,(a)は吸着状態を表す.
ここで,第1ステップであるAの吸着は予備平衡で,第2ステップが律速段階,また,Bの吸着はほとんどないとする.
さらに簡単のため,活性サイトは均質でかつ互いに干渉しないと仮定する.
このとき,Aの吸着速度は,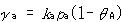 ,脱離速度は,
,脱離速度は,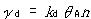 (nは活性サイト数,θAはAの表面被覆率).
(nは活性サイト数,θAはAの表面被覆率).
吸着速度は,気体分子の表面への衝突頻度(分圧原に比例),固着係数(表面に衝突した分子が表面に捉えられる確率),表面の空いている活性サイトの数に比例し,脱離は吸着量に比例すると考えられるからである.
Aの吸着は予備平衡と仮定したから,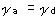 ,従って,
,従って,
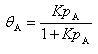 (15.5)
(15.5)
ここで,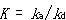 はAの吸着平衡定数である.
はAの吸着平衡定数である.
(15.5)式をラングミュア(I.Langmuir)の吸着等温式ということがある.
次に,Bの生成速度γは,律速段階である第2ステップの1次反応速度定数をkとすると,次式で表される.
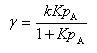 (15.6)
(15.6)
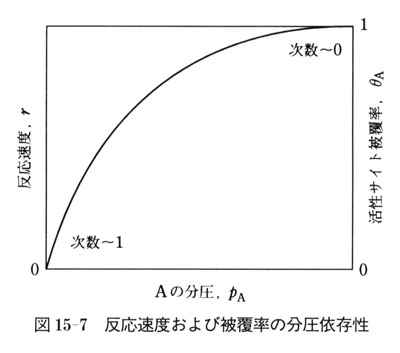
被覆度伍および反応速度γはAの分圧に対し図15-7の依存性を示すことになり,反応は,低圧では1次反応,高圧ではゼロ次反応になる.
もう少し複雑な反応メカニズムを紹介しよう.酸化マンガンのような酸化物触媒表面でのオゾンの分解反応(2O3(g) + 3O2(g))の例である.
(g)は気体,(a)は活性点(s)に吸着した状態を表す.
まず,オゾン分子は活性点で吸着酸素原子と酸素分子になり,この吸着酸素原子は,オゾンと反応して酸素分子と吸着ぺルオキシドを与える.
ペルオキシドの脱離が遅いステップである.
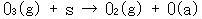 (15.7a)
(15.7a)
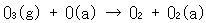 (15.7b)
(15.7b)
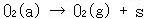 (15.7c)
(15.7c)
実際の触媒反応では,多くの分子種が共存し,また,活性点が不均質かつ互いの干渉があるのでさらに複雑になるが,基本はここで説明したとおりである.
このほかに,工業的な触媒反応では,反応器内に温度や濃度の分布があり,物質や熱の移動速度(細孔構造,触媒有効係数)など反応工学的な因子が活性,選択性に大きな影響を与える.



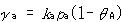 ,脱離速度は,
,脱離速度は,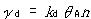 (nは活性サイト数,θAはAの表面被覆率).
(nは活性サイト数,θAはAの表面被覆率).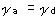 ,従って,
,従って,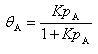 (15.5)
(15.5)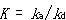 はAの吸着平衡定数である.
はAの吸着平衡定数である.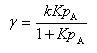 (15.6)
(15.6)
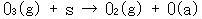 (15.7a)
(15.7a)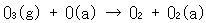 (15.7b)
(15.7b)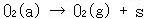 (15.7c)
(15.7c)