第2章 物質のもつエネルギー
物質が温度や圧力の関数でどんな状態をとるか,また,どのような化学変化を行うかは,物質に固有な物理量によって論ずることができる.
それは,熱力学の化学への応用である.
この章では,物質はそれを構成している原子分子の運動による固有なエネルギーをもつこと,そのエネルギーは温度の関数であることを学ぶ.
1.熱力学の対象
 熱力学の学問大系ができ上がるきっかけは,産業革命の主役であった蒸気機関の効率の限界を理論的に追求することであった.
熱力学の学問大系ができ上がるきっかけは,産業革命の主役であった蒸気機関の効率の限界を理論的に追求することであった.
それは,物質の構造,性質や反応を研究対象とする化学と関係が薄いように見える.
しかし,ラボアジエの元素表に「熱素」が入っていたように,熱が物質の化学変化にともなって出入りすることは昔からわかっていた.
したがって,熱の本性はエネルギーであって化学元素ではないことが熱力学の創始者達によって実証されると,物質は固有なエネルギーを有すると考えざるを得なくなった.
その結果,熱の移動やその仕事への変換についてうち建てられた熱力学の原則は,物質の状態変化や化学変化についても基本的な指針となることが判明した.
その研究を推進した人々,たとえば,ギブズ(J.W. Gibbs),ファント・ホッフ(J.W. van’t Hoff),ル・シャトリエ(H.L. Le Chatelier)が化学に物理化学という新しい分野を創設したのであった.
それは,物質の存在形態を状態量という普遍的なパラメーターで明らかにする学問体系であった.
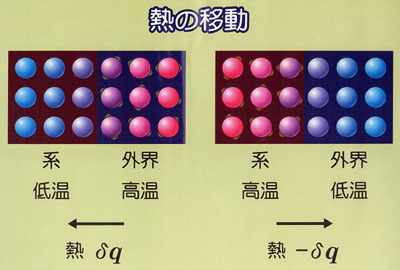
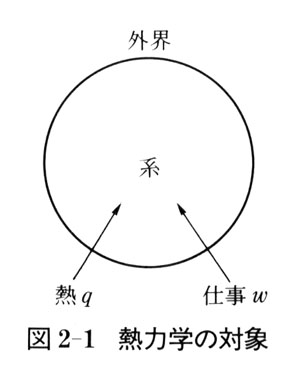
熱力学では,われわれが問題にする対象を系(system)といい,系の外の世界を外界(surroundings)という.
系は,多数の原子・分子を含むマクロな対象である.
系の性質が時間とともに変化しない状態になったとき系は平衡状態にあるという.
熱力学で対象とする系の状態は平衡状態であって,そこで一義的に定められる物理量が状態量である.
状態量には,系の物質量に比例する示量性の状態量と物質量に関係のない示強性の状態量がある.
前者の例は質量,モル数,体積,内部エネルギーなどであり,後者の例は圧力,温度,密度,モル体積などである.
系の平衡状態は,いくつかの状態量を与えると一義的に指定される.
純物質の系では,二つの示強性状態量,たとえば,圧力と温度の値を与えると,他の示強性状態量の値はすべて定まる.
さらに,これに加えてもう一つの示量性状態量,たとえば,物質のモル数の値を与えると,他の示量性状態量の値もすべて定まる.
系の状態を表す変数として選んだ状態量を状態変数という.
系によっては,密度などが部分的に違っていることがある.
そこで,他の部分と区別されない均一な部分を相という.
それが気体,液体,固体であるのに応じて気相,液相,固相という.
一つの相から成る系を均一系,二つ以上の相から成る系を不均一系という.
系が単一物質から成る場合,一成分系と呼び,二つ以上の成分を含む系を多成分系という.

 熱力学の学問大系ができ上がるきっかけは,産業革命の主役であった蒸気機関の効率の限界を理論的に追求することであった.
熱力学の学問大系ができ上がるきっかけは,産業革命の主役であった蒸気機関の効率の限界を理論的に追求することであった.

