第3章 熱化学
物質は固有なエンタルピーをもつ.
この章では,異なる物質のエンタルピーを比較するための手順を説明する.
すなわち,物質の化学変化にともなって放出,または,吸収するエネルギーがどのようにして決まるかを考え,また,それが分子の化学結合エネルギーや結晶の格子エネルギーに関連することを学ぶ.
1.物質のエネルギー状態
●標準状態
物質は固有なエネルギーをもつが,一定圧力のもとでそのエネルギーを議論する場合には,体積変化にともなう仕事を考慮したエンタルピーによってそのエネルギー状態を表すのが適切である.
物質のもつエンタルピーは条件によって変化するので,基準となる標準状態を定義する.
この定義は国際純粋応用化学連合(International Union of Pure and Applied Chemistry, IUPAC)の中に設けられた委員会で決定される.

現在の標準状態の定義を表3-1に挙げる.
標準状態における物質の熱力学状態量は右肩に または○の印をつけて,それが標準状態の状態量であることを表す.
または○の印をつけて,それが標準状態の状態量であることを表す.
ここで,注意しなければならないのは,標準圧力が1982年以前の へ変更されたことである.
へ変更されたことである.
圧力の変更の程度は小さいが厳密に考えると昔の標準熱力学関数の値は修正する必要がある.
なお,溶液の標準状態については7章で改めて説明する.
●標準エンタルピー
物質のエンタルピーは,モル熱容量をいろいろな温度で測定し,それを温度積分することによって得られる.
すなわち,物質を0 Kから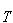 Kまで昇温させるためのエンタルピーは,
Kまで昇温させるためのエンタルピーは,
 (3.1)
(3.1)
である.
しかし,実際には,温度を高める途中で固体が融解して液体となったり,液体が蒸発して気体になるなどの相変化が起こる.
一つの例として四塩化炭素をとり上げる.
図3-1に示すように四塩化炭素は低温で結晶であり,0 Kから結晶Ⅰの転移温度225.5 Kまでのエンタルピー変化は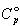 の温度積分となる.
の温度積分となる.
結晶形の変わる転移温度では,転移エンタルピー を加えると結晶Ⅱとなる.
を加えると結晶Ⅱとなる.

さらに,温度を高めると融解温度に達し,融解エンタルピー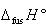 を加えることによって液体となる.
を加えることによって液体となる.
さらに,沸とう温度では蒸発エンタルピー によって気体となる.
によって気体となる.
標準状態において四塩化炭素を結晶状態の0 Kから気体状態の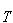 Kまで高めるためのエンタルピーは,
Kまで高めるためのエンタルピーは,
 (3.2)
(3.2)
となる.
なお,相変化,相平衡については6章で詳しく学ぶ.
一般に,物質のエンタルピーを定義する場合,相変化は考えない.
つまり,四塩化炭素の気体のエンクルピーは,0 Kまで気体であると仮定して を定義する.
を定義する.

気体の四塩化炭素と液体の四塩化炭素は相互変換可能な別の物質と考える.
いろいろな物質のエンタルピーは,温度の関数で後に説明する熱力学関数のデータベースによって知ることができる.

 または○の印をつけて,それが標準状態の状態量であることを表す.
または○の印をつけて,それが標準状態の状態量であることを表す. へ変更されたことである.
へ変更されたことである.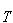 Kまで昇温させるためのエンタルピーは,
Kまで昇温させるためのエンタルピーは, (3.1)
(3.1)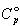 の温度積分となる.
の温度積分となる. を加えると結晶Ⅱとなる.
を加えると結晶Ⅱとなる.
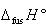 を加えることによって液体となる.
を加えることによって液体となる. によって気体となる.
によって気体となる.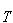 Kまで高めるためのエンタルピーは,
Kまで高めるためのエンタルピーは, (3.2)
(3.2) を定義する.
を定義する.