2.熱化学
●反応エンタルピー
物質の系が化学反応を起こして異なる物質の系に変化する過程は
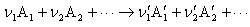 (3.3)
(3.3)
の反応式で一般に書ける.
左辺を原系または反応系,右辺を生成系という.
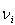 は,各成分の反応,生成のモル比を与えるもので化学量論係数である.
は,各成分の反応,生成のモル比を与えるもので化学量論係数である.
一定圧力かつ一定温度の条件で,反応を行うとき外界から系へ出入りするエンタルピー差を反応エンタルピー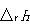 という.
という.
熱の吸収をともなう反応を吸熱反応,熱の発生をともなう反応を発熱反応と定義する.
発熱反応では,系の温度を一定に保つために熱エネルギーを外界へ移動させる必要があるので,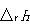 は負の値となる.
は負の値となる.
吸熱反応では,その逆である.
すなわち,

である.
なお,反応を標準状態で行わせたときの反応エンタルピーを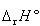 と書く.
と書く.
物質の燃焼に際しての反応エンタルピーを燃焼エンタルピー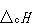 といい,ボンベ熱量計で測定される.
といい,ボンベ熱量計で測定される.
ボンベ熱量計は,物質を高圧の酸素雰囲気中で燃焼させ,その温度上昇より燃焼に際して放出される熱量を決定する.以下に例を示す.
 (3.4)
(3.4)
 (3.5)
(3.5)
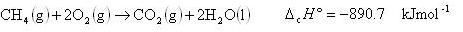 (3.6)
(3.6)
ここで,物質名の後にある括弧内のg,l,sの記号は,気体,液体,固体を意味する.
炭素はダイヤモンドと黒鉛の二つの結晶があるので,そのどちらかを指定する.
炭化水素類の燃焼生成物は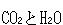 である.
である.
つまり,共通な生成物を持つことになる.
すると,炭化水素同士のエンタルピーの値を比較することができる.
それぞれの物質に対して固有なエンタルピーの値を定義すれば,物質の化学反応の際の反応エンタルピーを簡単に計算できるようになる.
それは熱力学第一法則の帰結である.
すなわち,反応エンタルピーは反応の経路によらず,反応が数段階に行われても一段で行われても不変である.
この法則は実験的にロシアの化学者ヘス(G.H. Hess)によって見出されたのでヘスの法則という.
たとえば,(3.4〜6)の三つの反応から
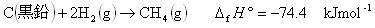 (3.7)
(3.7)
を導くことができる.
図3-2によってこの反応に関係する物質のエンタルピーを比較できる.
標準生成エンタルピーの定義は,「ある温度で標準状態にある1モルの化合物が標準状態にある成分元素の単体から生成する際のエンタルピー」で,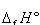 と書く.
と書く.
付録3にいくつかの化合物について標準生成エンタルピーを与える.*)
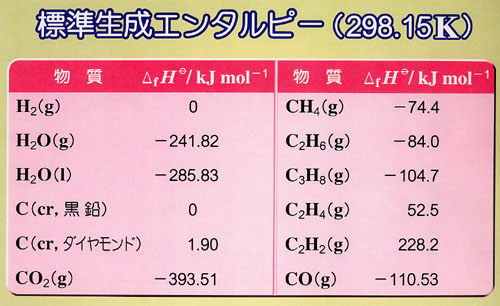
*)標準生成エンタルピーは,化学にとって極めて基礎的な重要なデータである.したがって,可能な限り正確な実験データを基にしていろいろな物質についてその値の収集がなされている.参考書の項目にデータ集として日本化学会編『化学便覧(第4版)』を挙げた.
標準生成エンタルピーを使うと,反応エンタルピーはどの反応についても一般的に表現できる.
反応(3.3)の生成系の各成分の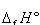 の和から反応系のそれを差し引けばよい.すなわち,反応エンタルビーは
の和から反応系のそれを差し引けばよい.すなわち,反応エンタルビーは
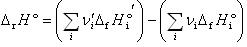
となる.
有機化合物の標準生成エンタルピーは,燃焼エンタルピーの測定によって求めるのが通例である.
しかし,無機化合物の場合,酸化反応よりもフッ化反応の方が定量的に反応し易いなどの理由から,フッ化反応のエンタルピーの測定によって標準生成エンタルピーを決定する.
●水溶液イオンのエンタルピー
われわれの身近にある反応に水溶液中のイオン反応がある.たとえば,
中和反応を考えよう.
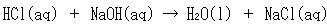 (3.9)
(3.9)
ここでaqは希薄水溶液の状態にあることを意味する.
上記の反応をHClとNaOHのいろいろな初期濃度の組み合わせについて行わせると,HClとNaOHの各1モル当りのエンタルピー変化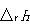 は濃度に依存する.
は濃度に依存する.
濃度がゼロになるにつれ,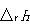 は一定値に近づく.
は一定値に近づく.
HClやNaOHの代わりに他の強酸や強塩基を用いてもその値は同じで,
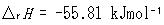
である.
これは,無限希釈溶液の極限では,水溶液中の各種のイオンは互いに独立に存在することを意味する.
すなわち,(3.9)の反応では,水素イオンと水酸イオンだけが反応している.したがって,反応式は
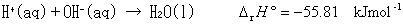 (3.10)
(3.10)
である.
ただし,反応は298.15 Kで行っている.
水溶液のイオンについても生成エンタルピーが定義できると便利である.
しかし,そのデータを実験で定めることはできない.
たとえば,気体のHClからHCl水溶液を生成するエンタルピー差を決めることはできる.
しかし,水素イオンと塩素イオンのそれぞれの生成エンタルピーを求める方法はない.
一つの方法は,水溶液に新しい基準状態を導入することである.
そのために,「希薄水溶液中の水素イオンH±(aq)の298.15 Kにおけ生成エンタルピーを零とする」という規約を設ける.
すると,他のイオンの生成エンタルピーは一義的に定めることができる.
水素イオンと水酸イオンから液体の水が生成するが,水については燃焼エンタルピーの測定値がある.
すると,水素イオンのエンタルピーの基準が定まれば,水酸イオンの生成エンタルピーは決定される.
この間の事情は,中和反応に関わる各成分のエネルギー関係を示した図3-3を参照するとよくわかる.
同様に,イオン反応のエンタルピーや溶解のエンタルピーから水溶液中の他のイオンの生成エンタルピーが求められる.
いくつかのイオンの生成エンタルピーを付録3の表に示す.
●反応エンタルピーの温度変化
生成エンタルピーの表では,298.15 K(25℃)の値が与えられていることが多い.
したがって,その温度における反応エンタルピーが生成エンタルピーから計算できるだけである.
他の温度の反応エンタルピーを求めたい場合には,反応系,生成系の298.15 Kからの温度変化に相当するエンタルピー差を考慮する必要がある.
そのためには,各成分の定圧モル熱容量 のデータが必要である.
のデータが必要である.
いま,(3.3)式のように反応を一般的に表すとする.
反応に関係する各成分 ,
, の標準エンタルピー(298.15 K)をそれぞれ
の標準エンタルピー(298.15 K)をそれぞれ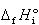 ,
,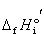 とし,
標準モル熱容量をそれぞれ
とし,
標準モル熱容量をそれぞれ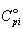 ,
,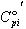 とする.
とする.
すると,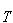 Kにおける反応エンタルピー は次の式
Kにおける反応エンタルピー は次の式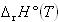 で表される.
で表される.
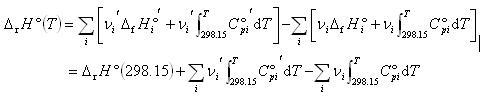 (3.11)
(3.11)
この場合,反応系と生成系で温度変化に要する熱エネルギーに差がなければ,反応エンタルピーは温度によって大きな変化をしない.
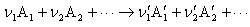 (3.3)
(3.3)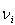 は,各成分の反応,生成のモル比を与えるもので化学量論係数である.
は,各成分の反応,生成のモル比を与えるもので化学量論係数である.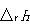 という.
という.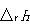 は負の値となる.
は負の値となる.
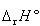 と書く.
と書く.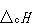 といい,ボンベ熱量計で測定される.
といい,ボンベ熱量計で測定される. (3.4)
(3.4) (3.5)
(3.5)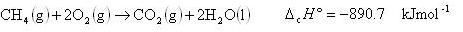 (3.6)
(3.6)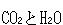 である.
である.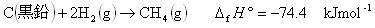 (3.7)
(3.7)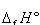 と書く.
と書く.

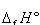 の和から反応系のそれを差し引けばよい.すなわち,反応エンタルビーは
の和から反応系のそれを差し引けばよい.すなわち,反応エンタルビーは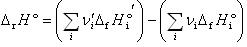

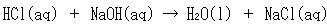 (3.9)
(3.9)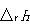 は濃度に依存する.
は濃度に依存する.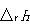 は一定値に近づく.
は一定値に近づく.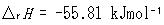
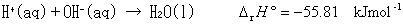 (3.10)
(3.10)
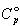 のデータが必要である.
のデータが必要である.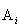 ,
,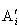 の標準エンタルピー(298.15 K)をそれぞれ
の標準エンタルピー(298.15 K)をそれぞれ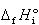 ,
,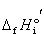 とし,
標準モル熱容量をそれぞれ
とし,
標準モル熱容量をそれぞれ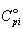 ,
,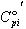 とする.
とする.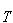 Kにおける反応エンタルピー は次の式
Kにおける反応エンタルピー は次の式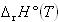 で表される.
で表される.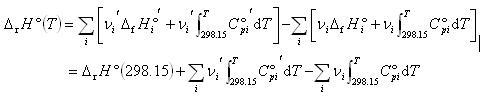 (3.11)
(3.11)