2.物質のギブズエネルギー
●標準生成ギブズエネルギー
物質の変化,化学反応が起こり易いかどうかは,その変化にともなうギブズエネルギー変化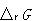 を調べればよい.
を調べればよい.
標準状態で起こる反応を観察する場合,標準状態において物質が成分元素の単体から生成する反応のギブズエネルギー変化,すなわち,標準生成ギブズエネルギーを定義すると大変都合がよい.
既に,標準生成エンタルピー,標準エントロピーが求められているから,これらから標準生成ギブズエネルギーを求めるのは容易である.
付録3に主な物質の標準生成ギブズエネルギーを表として与えた.
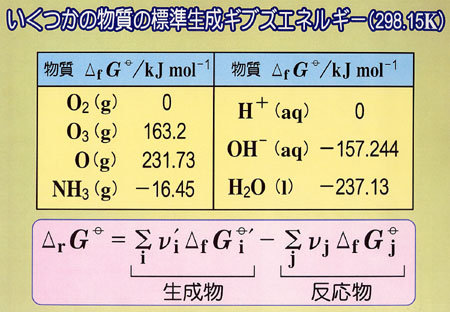
標準生成ギブズエネルギーは,標準状態で安定な元素単体を基準とするので,たとえば,O2(g)の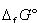 は0であるが,O3(g)は正に大きい値で,O3がO2から生成する可能性は小さい.
は0であるが,O3(g)は正に大きい値で,O3がO2から生成する可能性は小さい.
一方,NH3(g)は負の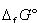 をもつわけで,N2やH2の元素単体から生成することができる.
をもつわけで,N2やH2の元素単体から生成することができる.
それについてはもう一度議論することにする.
水溶液イオンの反応では,H+(aq)の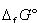 を基準にする.すなわち,H+(aq)の
を基準にする.すなわち,H+(aq)の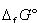 は0である.
は0である.
たとえば,中和反応では,H2O(l)の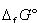 が負に大きいので中和反応はぼぼ完全に進行する.
が負に大きいので中和反応はぼぼ完全に進行する.
つまり,化学平衡は生成物のH2O側に非常に偏っている.
化学反応を一般的に
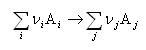 (5.13)
(5.13)
のように書けば,反応のギブズエネルギー変化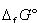 は生成物のギブズエネルギーから反応物のそれを差し引いたものとなる.すなわち,
は生成物のギブズエネルギーから反応物のそれを差し引いたものとなる.すなわち,
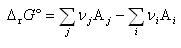 (5.14)
(5.14)
である.
この場合,(5.13)式の反応式で右辺が生成物で,左辺が反応物である.
右辺と左辺を逆にすると,生成物が反応物に,反応物が生成物となり,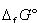 の符号が変わるので注意する必要がある.
の符号が変わるので注意する必要がある.
●化学ポテンシャル
これまでは,標準状態,一定温度(25℃)の下の物質のギブズエネルギーを考えてきた.
気体の場合,高い圧力の気体は自発的に低い圧力の気体になろうとする傾向がある.
したがって,ギブズエネルギーは圧力に依存する.
いま,温度一定の下でのギブズエネルギーの微少変化を考えよう.
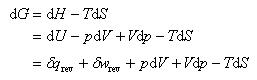
である.
ここで,体積変化にともなう仕事のみを考え,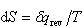 であることに注意すれば
であることに注意すれば
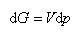 (5.15)
(5.15)
が得られる.
したがって,気体物質が標準圧力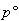 から圧力
から圧力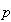 へ変化するときのギブズエネルギーの変化は,
へ変化するときのギブズエネルギーの変化は,
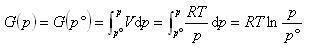 (5.16)
(5.16)
である.
すなわち,圧力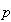 の気体のギブズエネルギーは
の気体のギブズエネルギーは
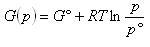 (5.17)
(5.17)
である.
いま,いろいろな化学種が共存する混合気体を考える.
成分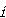 のモル当りのギブズエネルギーを考え,これを成分
のモル当りのギブズエネルギーを考え,これを成分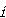 の化学ポテンシャルという.化学ポテンシャルは
の化学ポテンシャルという.化学ポテンシャルは
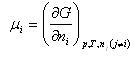 (5.18)
(5.18)
と定義され,成分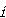 の分圧を
の分圧を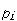 とすれば
とすれば
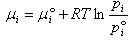 (5.19)
(5.19)
である.
は成分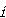 の標準ギブズエネルギーである.
の標準ギブズエネルギーである.
溶液中の成分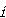 の化学ポテンシャルも同様に定義できる.
の化学ポテンシャルも同様に定義できる.
この場合,混合気体の分圧に相当するのがモル濃度である.
溶液中の溶質Bの化学ポテンシャルは,標準状態を質量モル濃度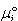 を基準にとると
を基準にとると
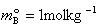 (5.20)
(5.20)
である.
また,モル濃度 を基準にすれば
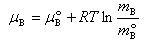 (5.21)
(5.21)
となる.
溶質の化学ポテンシャルが上式のように表される溶液を理想溶液という.このことに関しては,7章溶液で詳しく取り上げる.
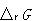 を調べればよい.
を調べればよい.
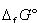 は0であるが,O3(g)は正に大きい値で,O3がO2から生成する可能性は小さい.
は0であるが,O3(g)は正に大きい値で,O3がO2から生成する可能性は小さい.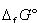 をもつわけで,N2やH2の元素単体から生成することができる.
をもつわけで,N2やH2の元素単体から生成することができる.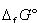 を基準にする.すなわち,H+(aq)の
を基準にする.すなわち,H+(aq)の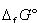 は0である.
は0である.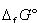 が負に大きいので中和反応はぼぼ完全に進行する.
が負に大きいので中和反応はぼぼ完全に進行する.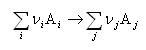 (5.13)
(5.13) は生成物のギブズエネルギーから反応物のそれを差し引いたものとなる.すなわち,
は生成物のギブズエネルギーから反応物のそれを差し引いたものとなる.すなわち,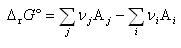 (5.14)
(5.14) の符号が変わるので注意する必要がある.
の符号が変わるので注意する必要がある.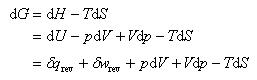
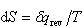 であることに注意すれば
であることに注意すれば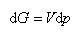 (5.15)
(5.15)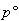 から圧力
から圧力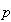 へ変化するときのギブズエネルギーの変化は,
へ変化するときのギブズエネルギーの変化は,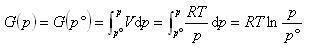 (5.16)
(5.16)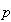 の気体のギブズエネルギーは
の気体のギブズエネルギーは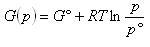 (5.17)
(5.17)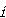 のモル当りのギブズエネルギーを考え,これを成分
のモル当りのギブズエネルギーを考え,これを成分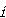 の化学ポテンシャルという.化学ポテンシャルは
の化学ポテンシャルという.化学ポテンシャルは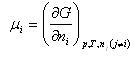 (5.18)
(5.18)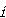 の分圧を
の分圧を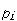 とすれば
とすれば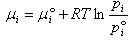 (5.19)
(5.19)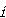 の標準ギブズエネルギーである.
の標準ギブズエネルギーである.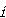 の化学ポテンシャルも同様に定義できる.
の化学ポテンシャルも同様に定義できる.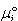 を基準にとると
を基準にとると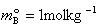 (5.20)
(5.20)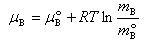 (5.21)
(5.21)