6 相平衡
物質は固体,液体,気体の三つの形態のいずれかをとる.
この物質の存在形態を相という.
物質がどのような条件でどのような相をとるのかは,前章で学んだ平衡の条件「ギブズエネルギーが最小となる」によって決まる.
この章では,物質の相平衡の条件,すなわち相律とそれに基づく純物質の状態図を学ぶ.
1.相律
●相
物質系のどの部分をとってもその性質が同じである場合,それを均一系という.
たとえば,純物質の気体,液体や固体,混合気体,溶液,固溶体などである.これに対して,系全体を通して性質が一様でなく境界面をもつような系を不均一系という.
系の中で,他の部分と明確な境界で区別される均一な部分を相(phase)という.
この名は,「外観」というギリシャ語に基づいてギブズによって提案された.
水と水蒸気から成る不均一系は液相と気相の二つの相を含む.
水と氷の系では,氷がいくつかの破片に分かれていても氷は一つの相と見倣される.
二つ以上の相が共存する平衡を相平衡といい,化学平衡とともに熱力学の重要な応用分野である.
●相律
相平衡を律している条件を相律と呼ぶ.
相律は米国イエール大学のギブズによって導かれたが,1875年から78年にかけてコネチカット科学アカデミー紀要という地方の学会誌に発表されたので,20年近く世に知られなかった.
ドイツの物理化学者オストワルド(F.W.Ostwald)がその論文をドイツ語に翻訳して紹介した後,ギブズの業績が一般に認められるようになった.
相平衡の条件には,次の三つがある.
第一に,異なる相の間に熱的な平衡が成立すること.
第二に,異なる相の圧力は等しいこと.
第三に,異なる相の各成分の物質移動が釣り合っていること.
いま,P個の相が平衡にあり,各相はC成分から成るとする.すると,上記の条件を表す式は次のようになる.
 (6.1)
(6.1)
 (6.2)
(6.2)
 (6.3)
(6.3)
ここで,上つきの添字は相を示し,下つき添字は成分を表す.
物質は,その化学ポテンシャルの高い相から低い相へ移動する.
化学ポテンシャルという名前は,このことに基づいてギブズによって命名された.
(6.3)式は,平衡にある相の間で実質的な物質の移動が起こらないことを表す条件式である.
各相の組成は(C-1)個の独立な組成変数(モル分率など)によって指定される.

これに温度と圧力を加えて,各相は(C + 1)個の示強性状態変数でその状態が指定できる.
P個の相の全体の状態を指定するための示強性状態変数の総数はP(C + 1)個である.
一方,(6.1〜3)の条件式は,T,p,μi(i = 1,2,…,C)について(P - 1)個ある.
つまり,条件式の総数は,(P - 1)(C + 2)個である.
状態変数の総数が条件式の総数よりも多ければ,その状態変数を自由に選ぶことができる.
示強性状態変数の総数より条件式の総数を引いたものを系の自由度または可変度という.自由度または可変度をFとすれば
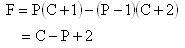 (6.4)
(6.4)
となる.
自由度が0,1,2,3の系を不変系,一変系,二変系,三変系という.
 (6.1)
(6.1) (6.2)
(6.2) (6.3)
(6.3)
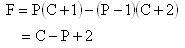 (6.4)
(6.4)