2.気相−液相平衡
●ラウールの法則
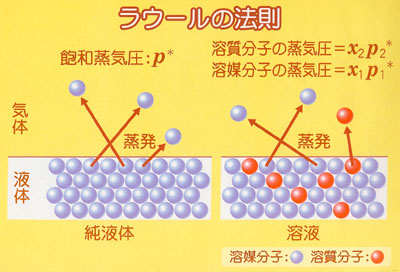
二つ以上の成分が溶け合った液体と平衡となっている気相中の成分iの分圧piはi成分の液相中のモル分率xiとその飽和蒸気圧pi *との積となる.
すなわち,
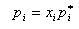 (7.2)
(7.2)
である.
このラウールの法則は,二つの成分分子の液相中における分子間力が等しいという前提で成立する.
すなわち,構造の類似した分子種の混合溶液においてこの法則は成立する.
ラウールの法則が成立する溶液を理想溶液という.


成分iの化学ポテンシャルは
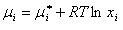 (7.3)
(7.3)
となる.
ここでμi*成分iの純粋な液体の化学ポテンシャルである.
理想溶液の定義は,その成分の化学ポテンシャルが(7.3)式で書けることである.
ここで,この式よりラウールの法則を導けることを示そう.
成分iの気体の飽和蒸気圧をpi *とすると,その化学ポテンシャルは液体のそれと等しい.
すなわち,
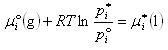 (7.4)
(7.4)
が成立する.
したがって,飽和蒸気圧は
}
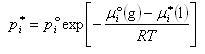 (7.5)
(7.5)
と表される.
成分iが液相と気相とにおいて平衡となる場合,
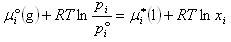 (7.6)
(7.6)
条件が成立するから
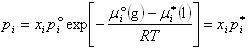 (7.7)
(7.7)
となってラウールの法則を導くことができる.
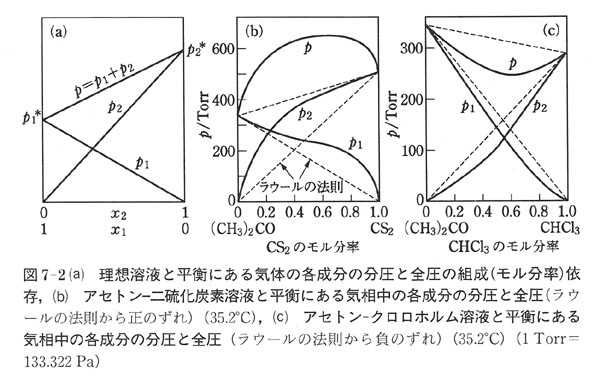
図7-2(a)は,二成分の溶液と平衡にある気体中の二つの成分の分圧をモル分率の関数で描いたものである.
ラウールの法則が成立する場合には,二つの成分の分圧はモル分率に比例し,気相の圧力はモル分率に対して直線となる.
多くの溶液でラウールの法則は正確には成立しない.
それは成分分子間の分子間力は,同じ分子同士のそれと違っているからである.
図7-2(b)はラウールの法則から正にずれた場合で,図7-2(c)は負にずれた場合である.
正にずれた場合には全圧に極大が,負にずれた場合には極小が出現する.
●圧力一組成図
温度一定の条件下で,二成分系の液相−気相平衡を考える.
相律によれば自由度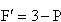 であるから,P = 1,つまり,液相または気相では自由度は2で,組成と圧力を自由に選択できる.
であるから,P = 1,つまり,液相または気相では自由度は2で,組成と圧力を自由に選択できる.
一方,液相と気相が共存する場合は,自由度は1となる.組成を定めると圧力は指定される.
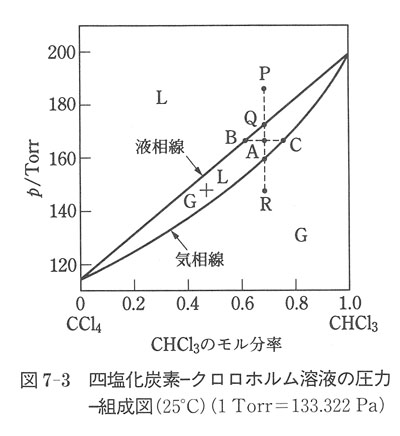
図7-3は理想溶液に近い四塩化炭素とクロロホルムの溶液の気相と平衡を示す圧力−組成の関係を示す状態図である.
Lと記した領域では液相すなわち溶液が存在する.
この場合,二つの成分はどんな割合でも均一に溶け合うことを前提にしている.Gと記した領域では気相が存在する.
二つの曲線に囲まれた領域では,液相と気相が共存する.
上の曲線は,液相の組成と圧力(全蒸気圧)の関係を示し,液相線と呼ばれる.下の曲線は気相の組成と圧力の関係を示し,気相線と呼ばれる.
ラウールの法則が成立する場合,液相線は直線となり,気相線は計算で求めることができる.
液相の成分1のモル分率が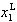 の場合,液相線の圧力は,
の場合,液相線の圧力は,
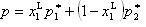 (7.8)
(7.8)
となり,モル分率に対して直線となる.
また,気相のモル分率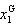 は,
は,
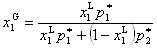 (7.9)
(7.9)
となる.
半月形の領域の一点Aをとると,この点の組成のモル分率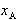 は液相と気相に分かれて共存する.
は液相と気相に分かれて共存する.
A点で引いた水平線が液相線と交わる点をB,気相線と交わる点をCとすると,B,Cに相当する組成が共存する液相,気相の組成を与える.
共存する液相,気相の両成分の全モル数をそれぞれ,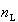 ,
,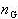 なとすると,液相中の成分1のモル数は
なとすると,液相中の成分1のモル数は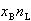 ,気相中のそれは
,気相中のそれは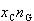 である.
である.
したがって,
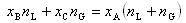
であって,
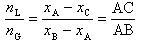 (7.10)
(7.10)
となる.
この関係式は「てこの規則」と呼ばれる.てこの規則は,二成分系で二つの相が共存する場合に一般的に成立する式である.
四塩化炭素−クロロホルム二成分系の圧力一組成図を示した図7-3で,P点では液相のみが存在する.
一定温度の下で圧力を下げると,Q点に達したところで気化を始める.
A点では,てこの規則を満たす組成の液相と気相が共存する.
R点に達すると全部が気化し,それ以下の圧力では気相のみが共存する.直線PQARを定組成線という.
ラウールの法則を満たさない図7-2(b)(c)の溶液の温度一定(35.2℃)の下での圧力−組成図を図7-4(a)(b)に示す.
液相線は図7-2(b)(c)に示したようにそれぞれ全圧に極大,極小をもつ.図の下の曲線は気相線で,液相と気相の組成は一致しない.
しかし,液相線の極大また極小の点では,気相線が接し,液相と気相の組成が一致する.
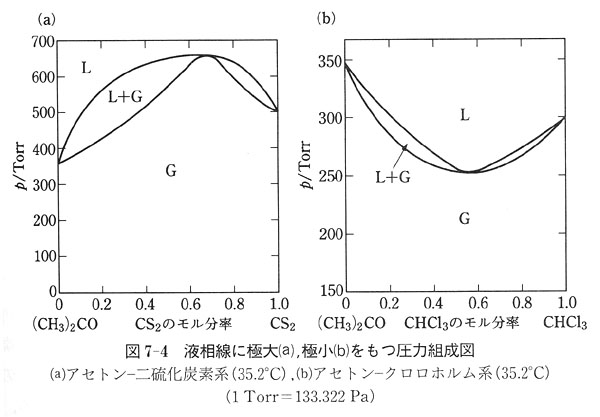
液相線と気相線によって囲まれた領域では,液相と気相が共存する.
この場合,たとえば,アセトン−二硫化炭素の系では,二硫化炭素のモル分率が0.65以下では気相で共存する液相より二硫化炭素に富み,そのモル分率が0.65以上ではその逆に液相で二硫化炭素に富んでいる.
●温度−組成図
二成分系の液相一気相平衡は,圧力を一定(とくに大気圧)にして温度1巨成図で表すことが多い.
それを沸点図という.
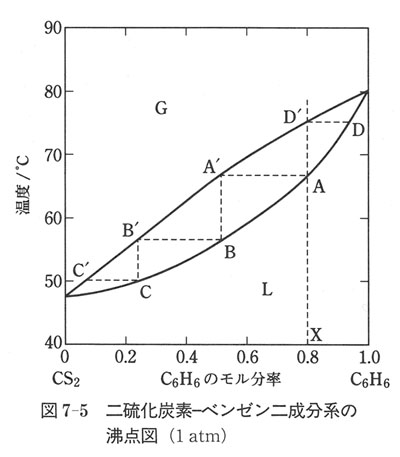
図7-5に二硫化炭素−ベンゼン系の沸点図を示す.
Gと書いた領域は気相状態,Lと書いた領域は液相状態を示す.
この領域を隔てる気相線と液相線があり,この二つの曲線に囲まれた領域では気相と液相が共存する.
液相線は,沸とうが始まる温度であるから沸とう曲線ともいう.
気相線は気相の組成が凝縮を始める温度なので,凝縮曲線または液化曲線ともいう.
いま組成Xの溶液を加熱しA点に達したとき沸とうを始め, の組成の気体を生ずる.
の組成の気体を生ずる.
そのまま温度上昇を続けると液相では組成がA→Dの変化をするのに対して蒸発気体の組成は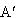 →
→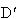 の変化をする.
の変化をする.
に達すると液体はすべて蒸発し,気体の組成は最初のそれと同じである.
溶液がA点に達したとき沸とうして生じた蒸気を凝縮させると,
生じた溶液はもとの溶液よりも二硫化炭素に富むBの組成をもつ.
これを再び,蒸発させて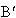 の組成の蒸気を生成させる.
の組成の蒸気を生成させる.
するとさらに二硫化炭素の含量の大きい溶液となる.
これを再び蒸発させ,凝縮させる.
このような手順を繰り返すと,沸点の低い成分を留出させることができる.
このような操作を分留という.
分留塔は,沸とうと凝縮を自動的に繰り返すことのできる装置である.
●共沸混合物
図7-4(a)のように圧力−組成図に極大が現れる場合には,沸点図に極小が現れる.
図7-6(a)のアセトン−二硫化炭素系の場合,極小点Mの組成に相当する溶液は一定温度で沸とうし,蒸発する気体の組成は溶液のそれと同じである.
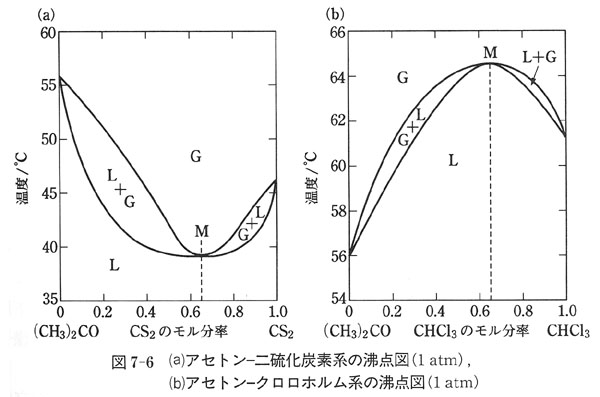
あたかも純物質のように振る舞う.
このような溶液を共沸混合物,M点を共沸点という.
圧力が変わると共沸混合物の沸点も組成も変わる.
したがって,それは化合物ではない.
この場合,共沸混合物よりアセトンに富む溶液を分留すると,留出分の組成は共沸混合物に近づき,残留分は純粋なアセトンに近づく.
また,共沸混合物よりも二硫化炭素に富む溶液の留出分は共沸混合物の組成に近づき,残留分は二硫化炭素に近づく.
この系では,分留によって両成分を純粋に分離することはできない.
図7-4(b)のように圧力−組成図に極小が現れる場合には沸点図に極大が現れる.
図7-6(b)のアセトン−クロロホルム系の沸点図に見られる極大点Mの組成が共沸混合物である.
共沸混合物よりもクロロホルムに富む溶液の蒸留では,クロロホルムにより富む蒸気が発生する.
また,混合物よりもアセトンに富む組成では,蒸留によって生成するのはよりアセトンに富む蒸気である.
沸点図に極大極小をもつような溶液では,分留によって分離できるのは共沸混合物といずれかの成分である.

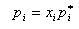 (7.2)
(7.2)

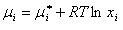 (7.3)
(7.3)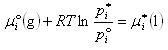 (7.4)
(7.4)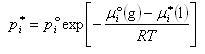 (7.5)
(7.5)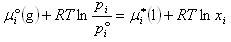 (7.6)
(7.6)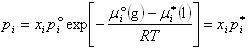 (7.7)
(7.7)
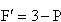 であるから,P = 1,つまり,液相または気相では自由度は2で,組成と圧力を自由に選択できる.
であるから,P = 1,つまり,液相または気相では自由度は2で,組成と圧力を自由に選択できる.
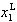 の場合,液相線の圧力は,
の場合,液相線の圧力は,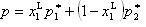 (7.8)
(7.8) は,
は,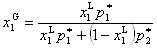 (7.9)
(7.9)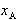 は液相と気相に分かれて共存する.
は液相と気相に分かれて共存する.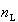 ,
,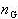 なとすると,液相中の成分1のモル数は
なとすると,液相中の成分1のモル数は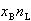 ,気相中のそれは
,気相中のそれは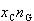 である.
である.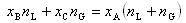
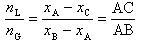 (7.10)
(7.10)

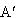 の組成の気体を生ずる.
の組成の気体を生ずる.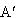 →
→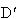 の変化をする.
の変化をする.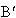 の組成の蒸気を生成させる.
の組成の蒸気を生成させる.